このページでは「化学反応式とは何か」「化学反応式が示す意味」「化学反応式のつくり方・書き方」を解説しています。
原子という言葉の意味(→【原子と分子】←を参考に)や化学式などを覚えたうえで読んでみてください。
動画による解説は↓↓↓
チャンネル登録はこちらをクリック↓↓↓
1.化学式の数字の意味
■「化学式の前の大きな数字」と「化学式の中の小さな数字」
化学式の前の大きな数字・・・そのうしろの集団の数を表す
化学式の中の小さな数字・・・その前の原子の数を表す
どちらも「1」は省略する。
記号「H」のうしろに小さな数字「3」が書かれています。
これはその前の「H原子」が何個あるかを示しています。
また記号「N」のうしろには小さな数字はありません。
しかしこれは「1」が省略されています。
つまり「1」も含めて書くと下のようになります。
よって小さな数字の「1」と「3」の意味は
その前の
「N原子」が1個・「H原子」が3個
あるという意味です。
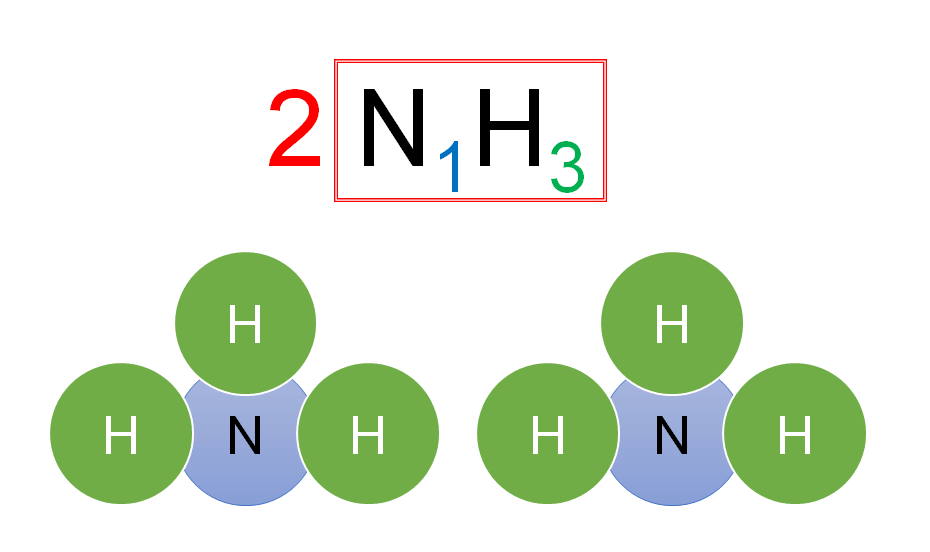
ここでNH3の前に書いてある大きな数字「2」の意味も考えます。
大きな数字は
そのうしろの化学式が表す集団の数
を示します。
この場合は「NH3という集団」が2つという意味です。
言い換えると「N原子が1個・H原子が3個」の集団が2つということになります。
ということは全部で
「N原子が2個・H原子が6個」あることになります。
これをモデルで表すと下図です。
N原子1個・H原子3個が結びついた集団をつくっています。
そしてこの集団が2つです。
この「集団」と「集団」は結びついているわけではないので、離して書きます。
(くっつけて書いてはいけない!)
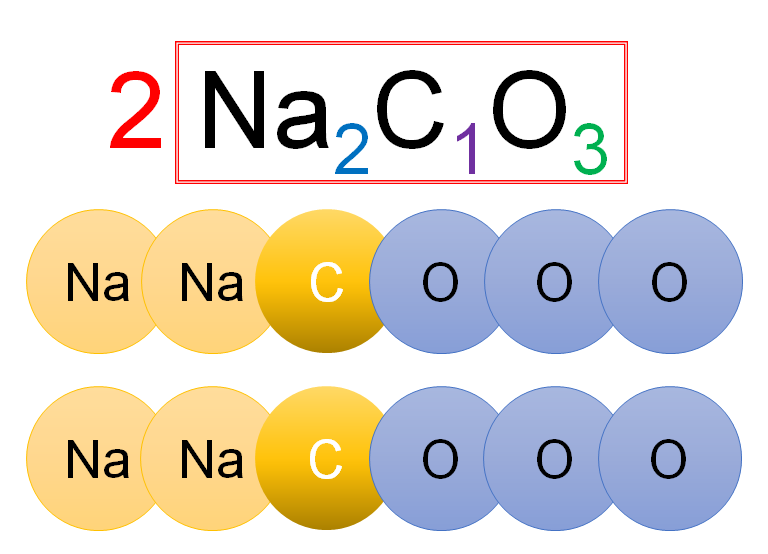
続いてはこの化学式の意味です。
省略されている「1」を書くと以下のようになります。
ということは
「Na原子が2個・C原子が1個・O原子が3個」の集団が2つ。
つまり全部で
「Na原子が4個・C原子が2個・O原子が6個」あります。
これをモデル図で表すと下図です。
POINT!!
・小さな数字・・・直前の原子の個数を表す
・大きな数字・・・うしろの原子たちの集団の個数を表す
2.化学反応式の意味
■化学反応式
化学変化のようすを化学式を用いて表したもの。
左辺に「反応前の物質」
右辺に「反応後の物質」
を書き、右向きの矢印「→」を使って表す。
※「→」を「=」と書いてはいけないですよ!
■ドルトンの原子説
化学変化の前後で、原子がなくなったり、新しくできたり、種類が変わることはない。
よって化学反応式では
「左辺の各原子の数」=「右辺の各原子の数」
とならなければならない。
(例)
次の化学反応式は「銅の酸化」を表しています。
この化学反応式の意味を説明します!
「銅の酸化」は言葉で書くと
銅 + 酸素 → 酸化銅
ですよね。
化学反応式を書くルールとして
「左辺の各原子の数」=「右辺の各原子の数」
が成り立たねばなりません。
そのために「化学式の前の大きな数字」が必要なんです。
この化学反応式中に省略されている「1」を書いてみましょう。
よって左辺には
「Cu原子が1個」という集団2つ・「O原子が2つ」という集団が1つ
ありますね。
また右辺には
「Cu原子が1個・O原子が1個」という集団が2つ
あることになります。
なので
「左辺のCu原子の数」=「右辺のCu原子の数」
「左辺のO原子の数」=「右辺のO原子の数」
が成り立っていますね。
ちなみにこれを表すモデル図は以下のようになります。
POINT!!
化学反応式では
・左辺・・・反応前の物質を表す
・右辺・・・反応後の物質を表す
・左辺と右辺で、各原子の個数が同じでなければならない!
3.化学反応式の書き方・作り方
(例)
水素の燃焼(水素と酸素が反応して水ができる)を例にして、化学反応式の書き方を説明していきます!
まず言葉で反応の様子を表すと
となりますね。
次に「大きな数字」はあとまわしで
「物質名」を「化学式」に書き換えましょう。
今のままでは
左辺:「H原子が2個」の集団が1つ・「O原子が2個」の集団が1つ
右辺:「H原子が2個・O原子が1個」の集団が1つ
という意味となり、O原子の数が合いません。
原子の数を合わせるときは「化学式の前の大きな数字」のみを調節します。
「化学式の中の小さな数字」は一切変えてはいけません。
O原子の数を合わせるため、右辺のH2Oの前に「2」を付けます。
これで
左辺:「H原子が2個」の集団が1つ・「O原子が2個」の集団が1つ
右辺:「H原子が2個・O原子が1個」の集団が2つ
となりました。
しかし今度はH原子の数が合いません。
H原子の数を合わせるため、左辺のH2の前に「2」を付けます。
これで
左辺:「H原子が2個」の集団が2つ・「O原子が2個」の集団が1つ
右辺:「H原子が2個・O原子が1個」の集団が2つ
となりました。
すべての原子の数が両辺で等しくなりましたね。
これで完成です。
これが化学反応式のつくり方、書き方です。
基本的に化学反応式は丸暗記するものではありません。
※「化学式」は暗記しなければなりません!
なるべく自力で「化学式の前の大きな数字」を調節し、化学反応式を完成させましょう。
ただしある程度覚えてしまうのも1つの手ではあります。
定期試験などでは暗記で対応できるでしょう。
POINT!!
化学反応式をつくるには
・化学式の中の小さな数字は変えてはいけない!
・化学式の前の大きな数字を調節する!
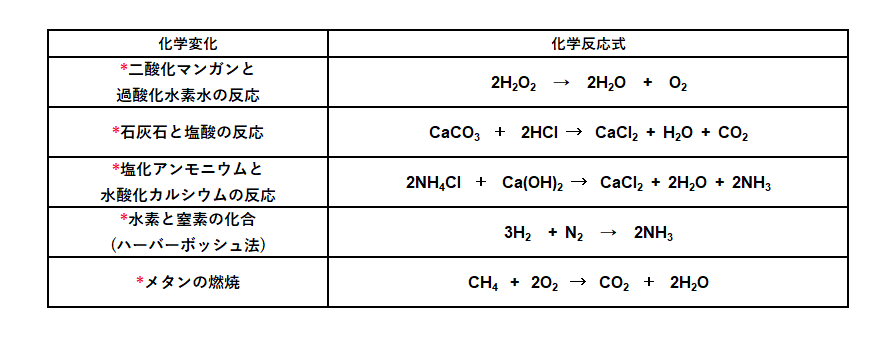
4.主な化学反応式
主な化学反応式を示します。
中学校で習うものはおそらくこれくらいです。
下の7つは中3になってからでもよいでしょう。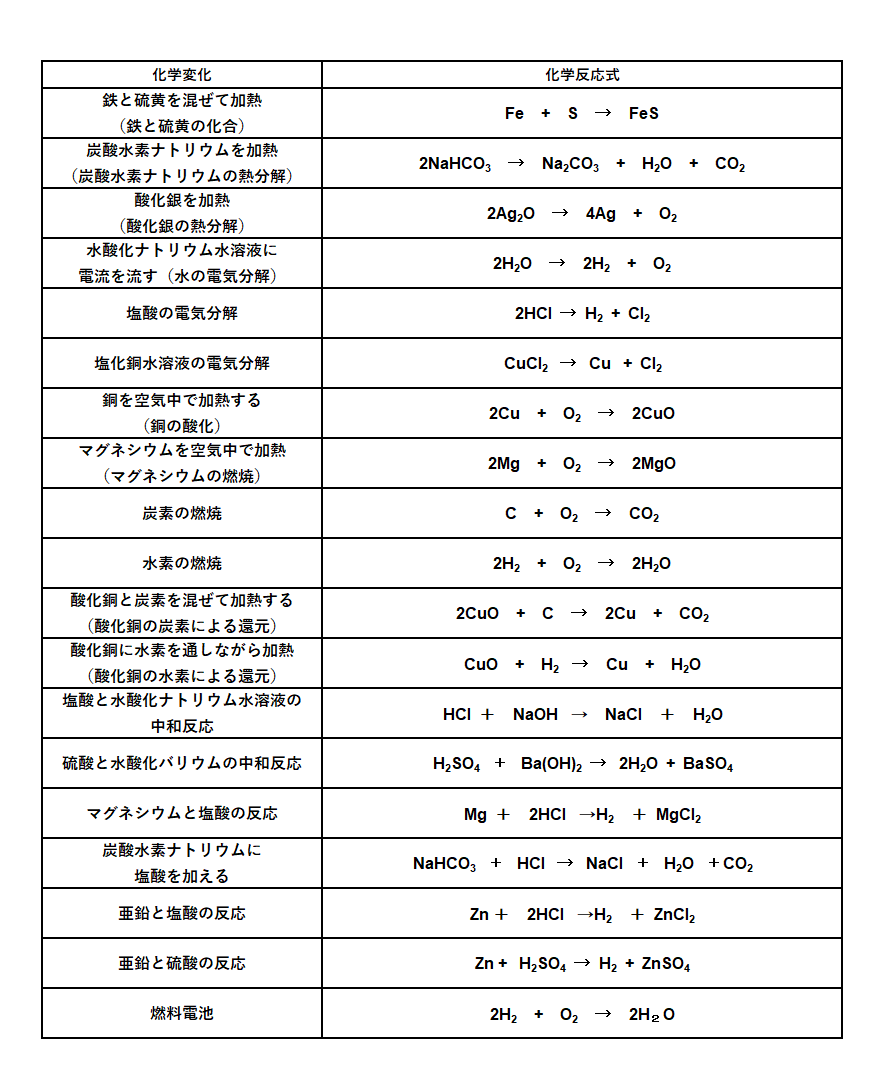
以下は私立高校の入試前に書けるようになればよいでしょう。
POINT!!
・化学式は必ず覚えておく。
・化学反応式では、左辺の各原子の数=右辺の各原子の数
・「小さな数字」を変えてはいけない。「大きな数字」のみ変える。
こちらもどうぞ
中2、中3生向けに化学反応式の練習教材を販売しています。(エクセル形式)
中2用と中3用があります。
ボタン1つで順番がランダムとなるテストが作成できます。

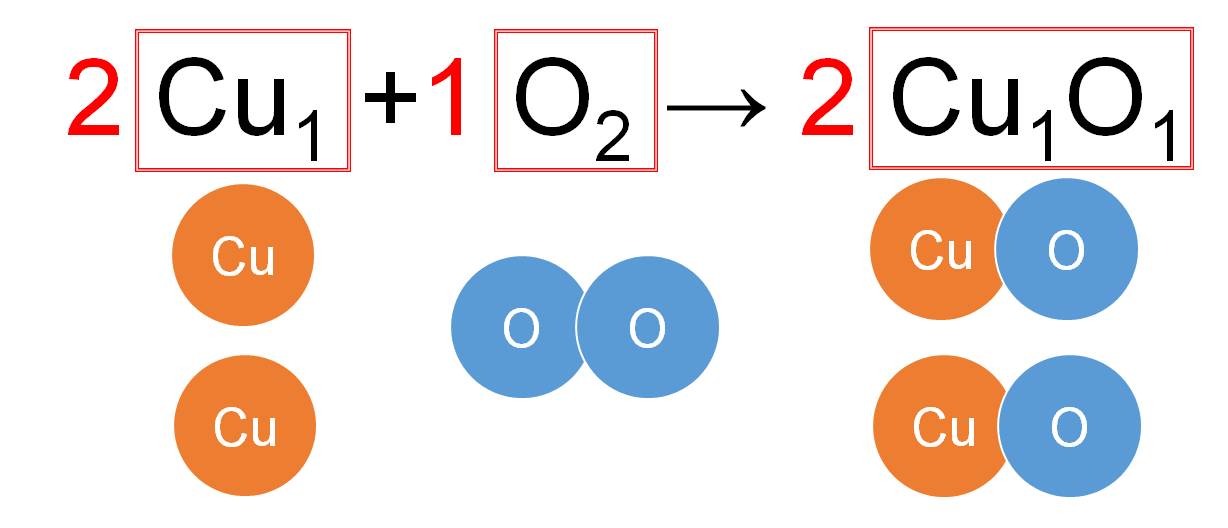


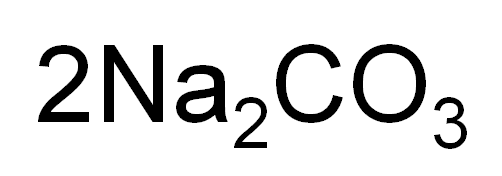

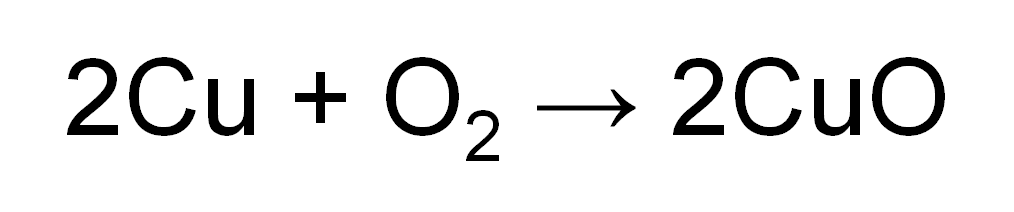
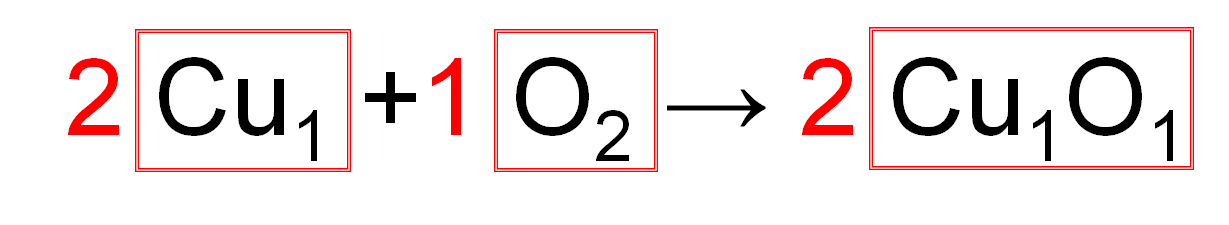

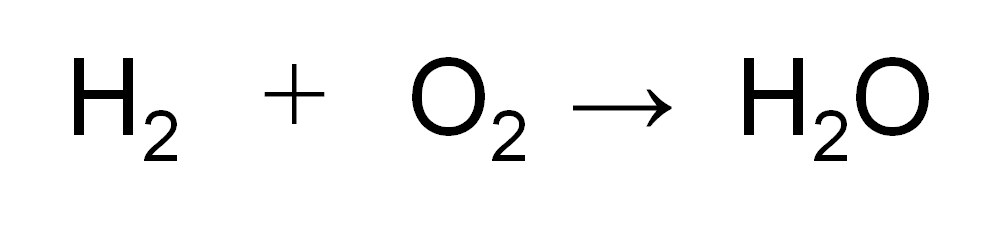
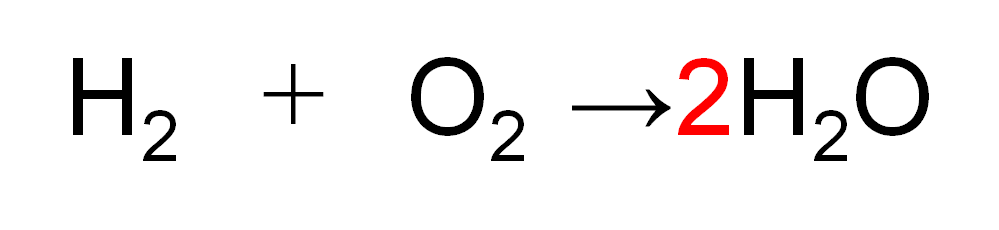
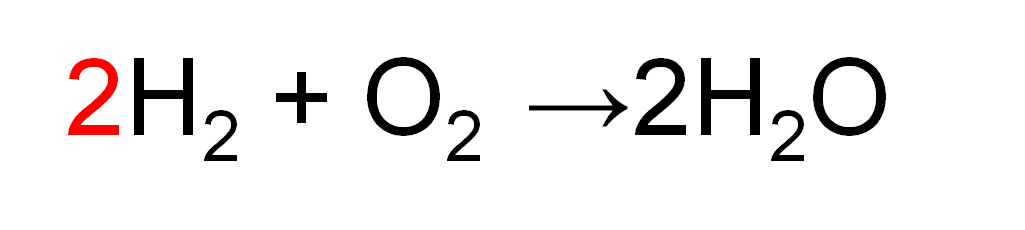

コメント(承認された場合のみ表示されます)
解説がとても分かりやすかったです!
これからも頑張ってください!
限りなく透明に近いワルツ様
コメントありがとうございます。
読んで理解してもらえたならとてもうれしいです。
また良ければご覧ください。