化合については・・・→【化合】←
分解については・・・→【分解】←
酸化については・・・→【酸化(燃焼)】←
還元については・・・→【還元】←
その他の化学変化の計算については
→【定比例の法則(酸化)】← または →【気体の発生に関する計算】←
化学反応式については→【化学反応式】←
で解説しています。
1.質量保存の法則
■質量保存の法則
反応の前後で質量の総和は変化しない。
→ 化学変化では原子の組み合わせは変わるが、原子の数や種類は変化しないため。
銅の酸化の化学反応式を見てみましょう。
反応前(左辺)にある原子の数は・・・銅原子が2個・酸素原子が2個
反応後(右辺)にある原子の数は・・・銅原子が2個・酸素原子が2個
となっており、原子の数や種類は変化していません。
よって
反応前の銅と酸素の質量の合計=反応後の酸化銅の質量の合計
となっているはずです。
このように
反応前の質量の総和と反応後の質量の総和が等しいことを
質量保存の法則といいます。
2.質量保存の法則のよくある問題
沈殿ができる反応についての問題
よく出題されるのが次の反応です。
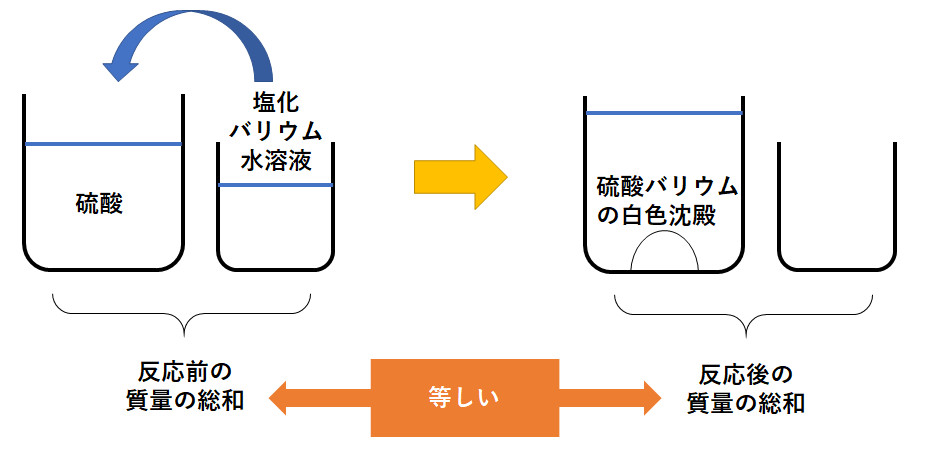
(反応の様子) 硫酸 + 塩化バリウム → 硫酸バリウム + 塩酸
(化学反応式) H2SO4 + BaCl2 → BaSO4 + 2HCl
硫酸の入った容器に塩化バリウム水溶液を加えていくと、溶液は白くにごります。
すなわち白い固体が溶液の底にたまります。
この白い固体は硫酸バリウムといいます。
この硫酸バリウムは水に溶けず、溶液の底にたまってしまいます。
(溶けずに底にたまるものを”沈殿”といいます。)
反応前の
「硫酸の入ったビーカー」の質量+「塩化バリウム水溶液が入ったビーカー」の質量
と
反応後の
「白い沈殿ができているビーカー」の質量+「塩化バリウム水溶液が入っていたビーカー」の質量
は質量保存の法則から等しくなります。(↓の図)
気体ができる反応についての問題
よく出題されるものは次の反応です。
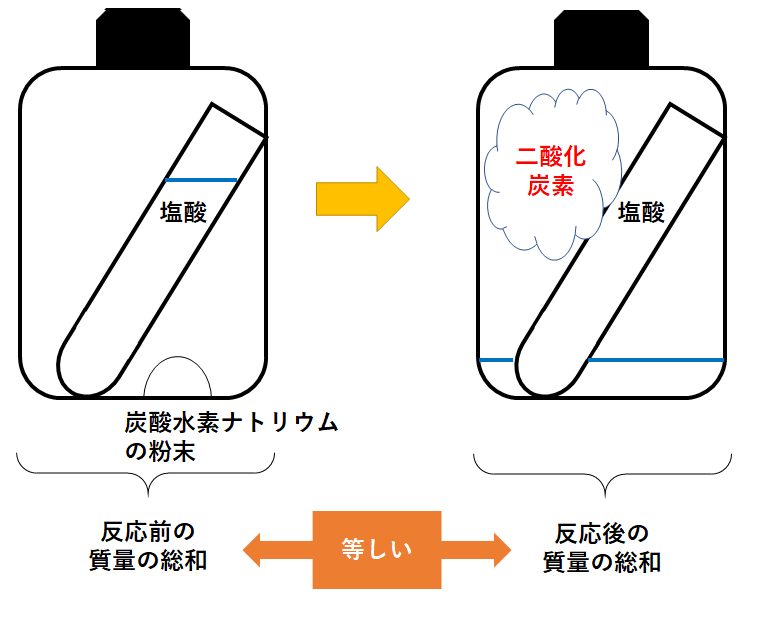
(反応の様子) 炭酸水素ナトリウム + 塩酸 → 塩化ナトリウム + 水 + 二酸化炭素
(化学反応式) NaHCO3 + HCl → NaCl + H2O + CO2
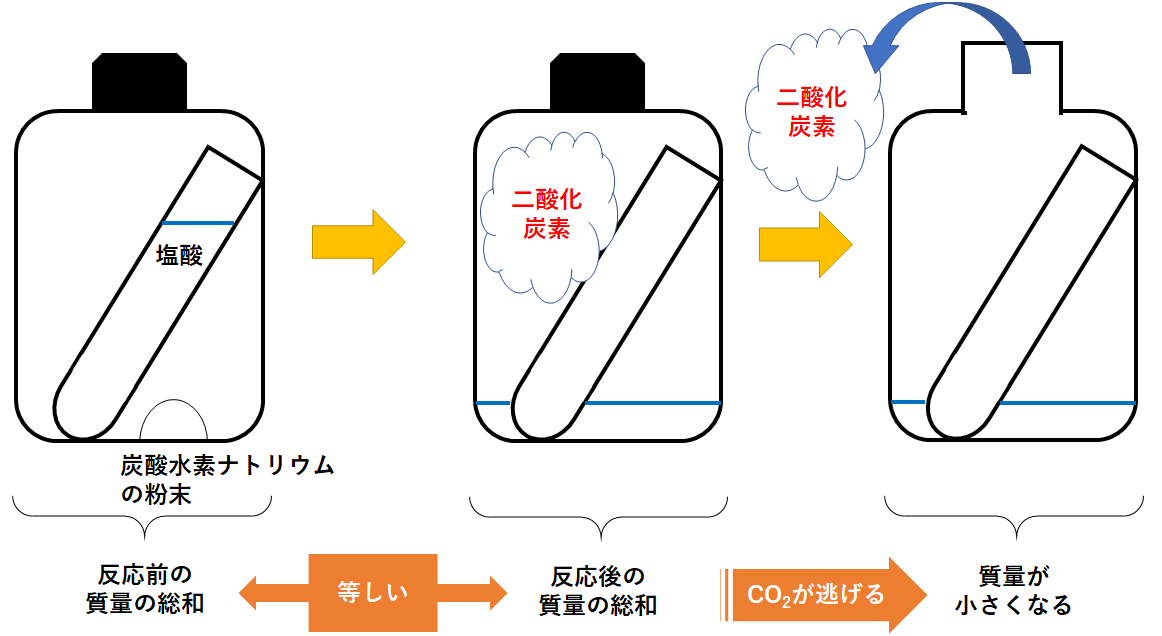
プラスチックの容器に、「うすい塩酸の入った試験管」と「炭酸水素ナトリウムの粉末」を一緒に入れます。
そしてプラスチックの容器にふたをして密閉しておきます。
その後、プラスチックの容器を傾けて塩酸と炭酸水素ナトリウムを反応させます。
このとき二酸化炭素が発生します。
このまま質量を測っても反応前と質量は変わりません。
ここでふたを外してしばらく置いておきます。
すると、容器内にあった二酸化炭素が空気中へ逃げてしまいます。
逃げた二酸化炭素の分だけ質量が減少してしまいます。
気体がつかわれる反応についての問題
よく出題されるものは次の反応です。
(反応の様子) 鉄 + 酸素 → 酸化鉄
※化学反応式は不要。
丸底フラスコの内部にスチールウール(鉄)を設置します。
これに導線をつなぎ電流を通して、スチールウールを熱して燃焼させます。
気体の出入りがないようにゴム管をピンチコックで閉めておきます。
このときスチールウールは酸化鉄へと変化します。
スチールウールはフラスコ内の酸素と反応して、酸化鉄になります。
フラスコ内の酸素が減少したため、フラスコ内の気圧は低下します。
ここでピンチコックを開けると外部の空気が入り込んでしまいます。
すると入り込んだ空気の分だけ質量が増加します。
POINT!!
・質量保存の法則が成り立つ理由は・・・
→ 化学変化では原子の組み合わせは変わるが、原子の数や種類は変化しないため。
・密閉空間であれば、質量は保存される。
・内部で気体が発生する反応・・・密閉空間でなければ質量は減少。
・内部で気体が使われる反応・・・密閉空間でなければ質量は増加。

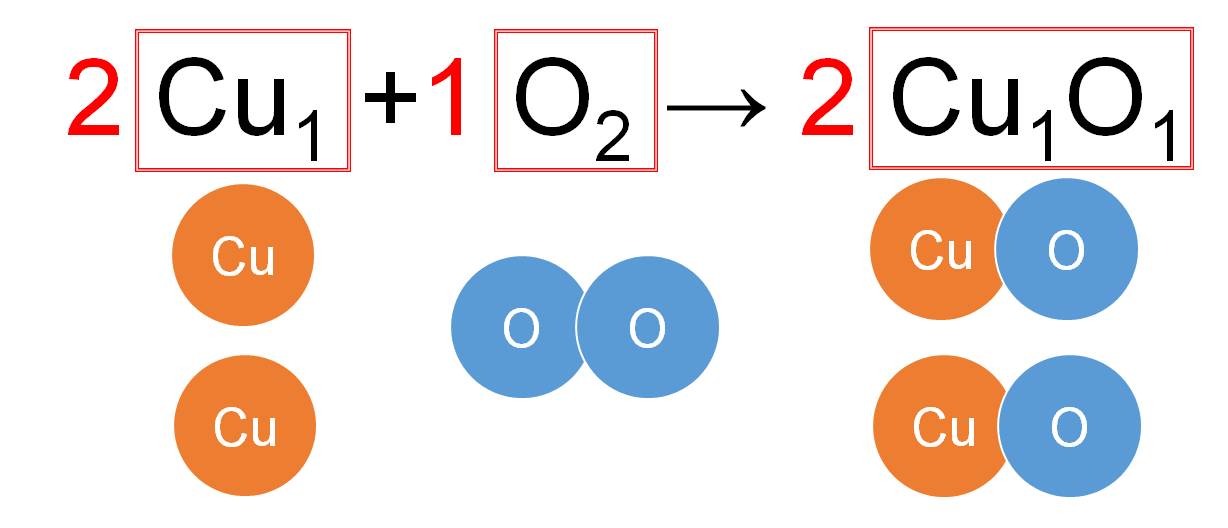



コメント(承認された場合のみ表示されます)
私は化学反応式が苦手で、覚えるのも一苦労でしたが、sciencetecherさんのおかげで中2の中間テストの点数が上がりました!!【前のテストより60→80にアップしました!!】本当にありがとうございました!!これからもテストがんばります!!sciencetecherさんも頑張ってください!!
れっちー中2様
コメントありがとうございます。
うれしいお言葉をありがとうございます。
ですが、テストの点数が上がったのはあなたが勉強したからです。
このサイトはほんの手助けにすぎません。
自信をもってこれからもがんばってください。