このページでは「銅の酸化」や「マグネシウムの酸化」といった代表的な化学の計算問題の解法を紹介しています。
その他の化学変化の計算については
→【定比例の法則(未反応・混合物)】←などで解説しています。
動画による解説は↓↓↓
チャンネル登録はこちらから↓↓↓
1.定比例の法則
物質どうしが反応する質量比はいつでも一定であること。
物質どうしの反応する質量比はいつでも決まっています。
たとえば銅の酸化の場合、銅と酸素は必ず4:1の質量比で反応します。
また水素が燃焼して水になる場合、水素と酸素は必ず1:8の質量比で反応します。
これは
・原子の質量は物質ごとに決まっている
・化合物をつくるときの原子数の比は常に一定
であるからです。
銅の酸化では
・銅原子の質量は酸素原子の4倍である
・酸化銅CuOは銅原子1個と酸素原子1個が結びついてできる
と決まっているので、反応の際の質量比は常に4:1となるのです。
その理屈よりも重要なのは・・・
その反応するときの質量比を利用して
「○○gの銅を酸化するには△△gの酸素が必要である」
といった計算をできるようにすることです。
よく出題されるのは
銅の酸化
マグネシウムの酸化(燃焼)
についての計算問題です。
これらの反応における、質量比は次のようになります。
この2つの反応の質量比は必ず覚えてしまいましょう。
※本来は覚えるものでもないのですが、覚えたほうが楽です。
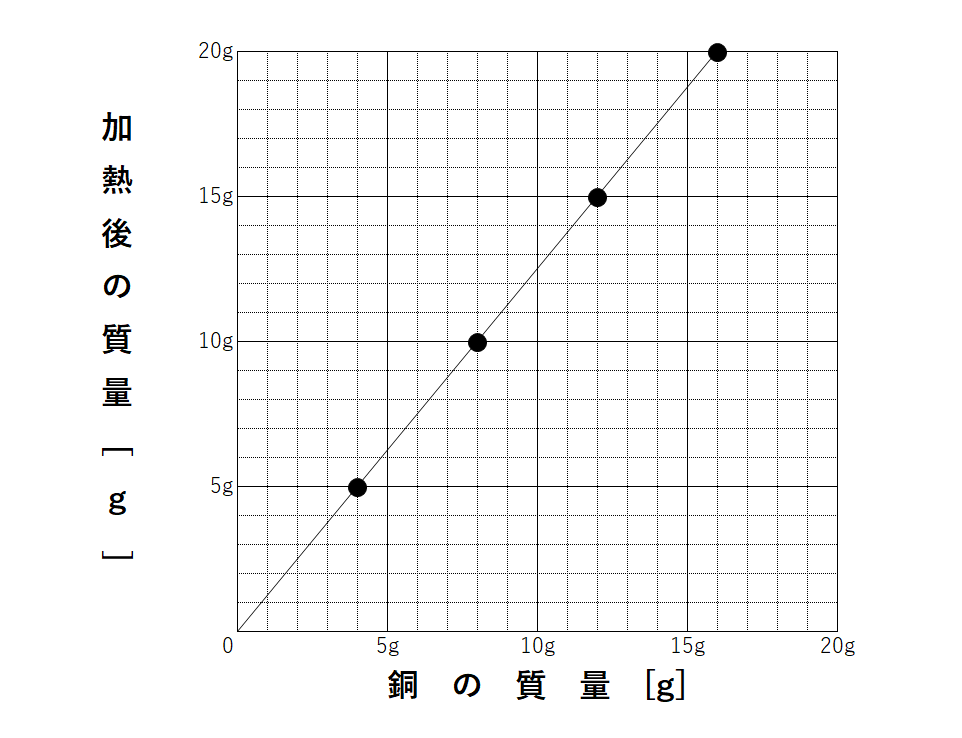
このように反応の質量比が決まっているので、銅と加熱後の物質(酸化銅)の質量の関係をグラフにすると↓のようになります。
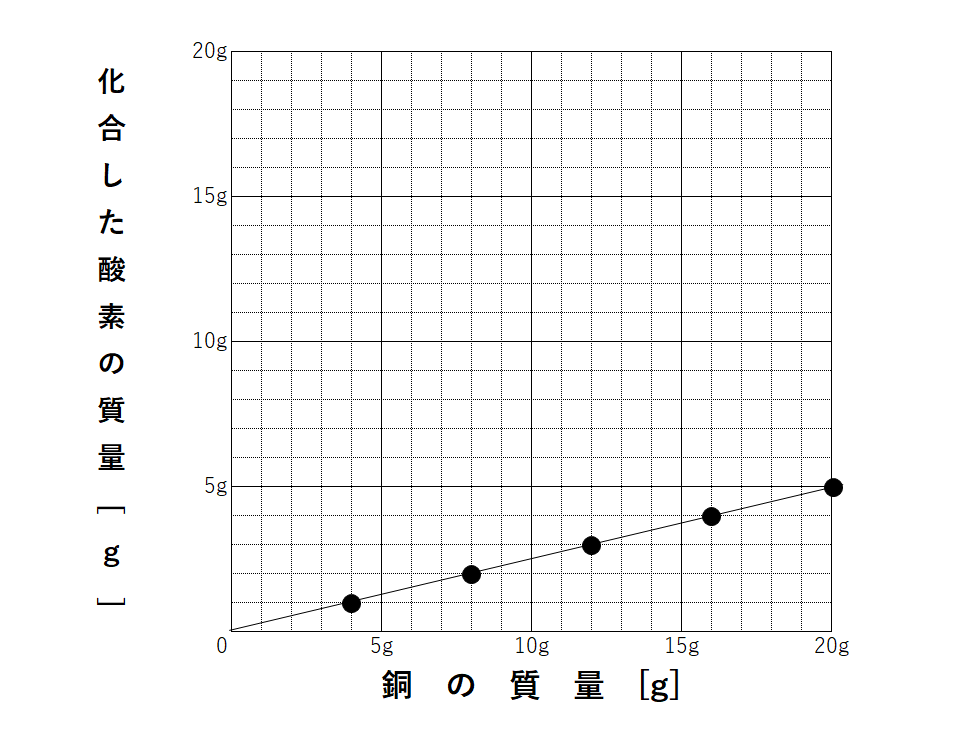
銅と酸素の質量の関係をグラフにすると↓のようになります。
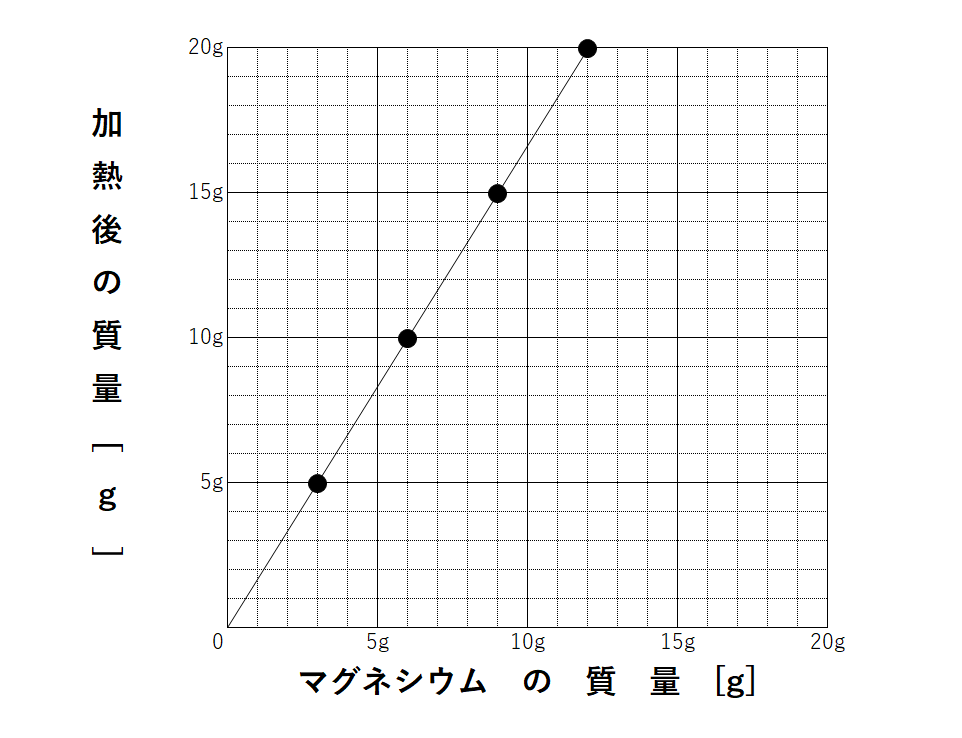
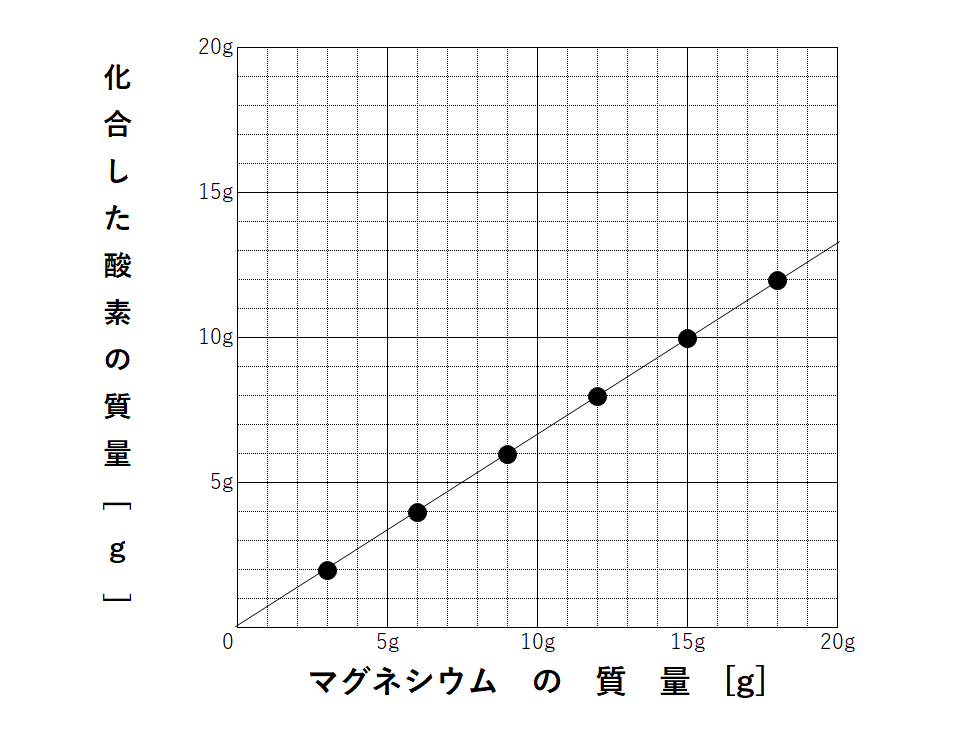
次に、マグネシウムと加熱後の物質(酸化マグネシウム)の質量の関係をグラフにすると↓のようになります。
マグネシウムと酸素の質量の関係をグラフにすると↓のように。
どれも比例のグラフになります。
問題ではこのようなグラフや表が必ず書かれています。
もし先ほどの4:1:5や3:2:5の比を忘れてしまった!という人は、グラフや表から比を求めてみましょう。
では以下に例題をいくつか見てみましょう。
【例題1】
(2) 銅3.6gを完全に酸化させると何gになるか。
(3) 酸化銅5.5gを生成させるのに何gの銅が必要か。
例題1の答えと解説
(1)
化学変化の計算では
・何と何が反応して何ができているか
・その反応の質量比はいくらか
・比例式を立てて答えを導く
この3STEPを常に意識しておくことが重要です。
この問題では
・銅と酸素が反応して酸化銅ができる
・その反応の質量比は4:1:5
であるので
求めたい酸素をx(g)として比例式をつくると
$$4:1=4.8g:x(g)$$
(銅:酸素という順の比例式)
$$x=1.2g$$
となります。
よって1.2gが正解です。
(2)
この問題では先ほどと同じく
・銅と酸素が反応して酸化銅ができる
・その反応の質量比は4:1:5
であるので
求めたい酸化銅の質量をx(g)として比例式をつくると
$$4:5=3.6g:x(g)$$
(銅:酸化銅という順の比例式)
$$x=4.5g$$
となります。
よって4.5gが正解です。
(3)
この問題でも先ほどと同じく
・銅と酸素が反応して酸化銅ができる
・その反応の質量比は4:1:5
であるので
求めたい銅の質量をx(g)として、比例式をつくると
$$4:5=x(g):5.5g$$
(銅:酸化銅という順の比例式)
$$x=4.4g$$
となります。
よって4.4gです。
【例題2】
(2) 酸素2.4gと化合できるマグネシウムは何gか。
(3) マグネシウム1.2gを完全に燃焼すると何gになるか。
例題2の答えと解説
(1)
先ほどとは反応する物質が変わり「マグネシウム」となりました。
・マグネシウムと酸素が反応して酸化マグネシウムができる
・その反応の質量比は3:2:5
であるため、
求める酸素をx(g)として、比例式をつくると
$$3:2=4.5g:x(g)$$
(マグネシウム:酸素という順の比例式)
$$x=3g$$
となります。
よって3gです。
(2)
前問と同じく、
・マグネシウムと酸素が反応して酸化マグネシウムができる
・その反応の質量比は3:2:5
であるので
求めたいマグネシウムをx(g)として、比例式をつくると
$$3:2=x(g):2.4g$$
(マグネシウム:酸素という順の比例式)
$$x=3.6g$$です。
よって3.6gです。
(3)
先ほど同じで
・マグネシウムと酸素が反応して酸化マグネシウムができる
・その反応の質量比は3:2:5
であるため
求めたい酸化マグネシウムをx(g)として比例式をつくると
$$3:5=1.2g:x(g)$$
(マグネシウム:酸化マグネシウムという順の比例式)
$$x=2g$$
です。
よって2gです。
POINT!!
以上のように、化学変化の計算問題では
・何と何が反応して何ができているかをチェック(反応のようす)
・そのときの反応の質量比
(Cu:O2:CuO=4:1:5 Mg:O2:MgO=3:2:5 は覚えてしまおう)
・比例式をつくって解く
の3ステップで解くのが基本です。
※未反応のものがある問題や混合物についての問題は→【定比例の法則(未反応・混合物)】←をご覧ください。
こちらもどうぞ
定比例の法則(銅の酸化やマグネシウムの酸化)の計算ドリルを販売しています。
PDF形式のダウンロード販売です。
1つ220円(税込)です。
よければどうぞ。

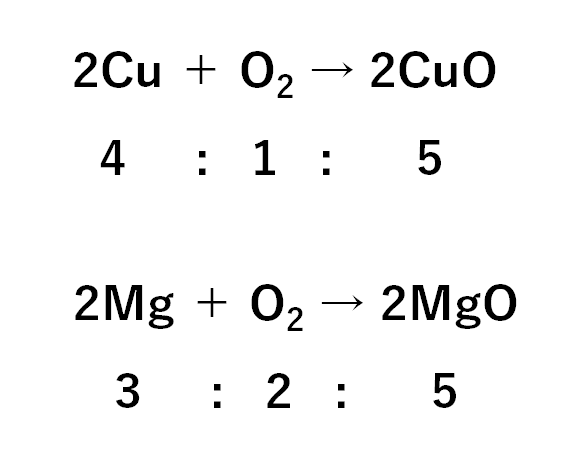
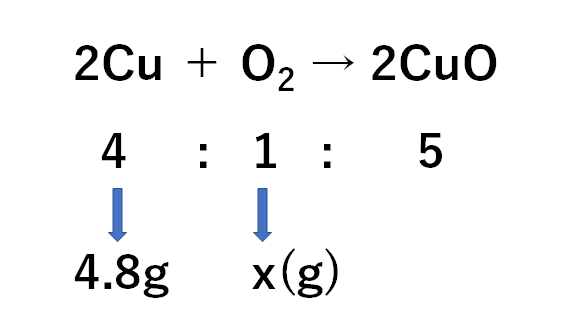
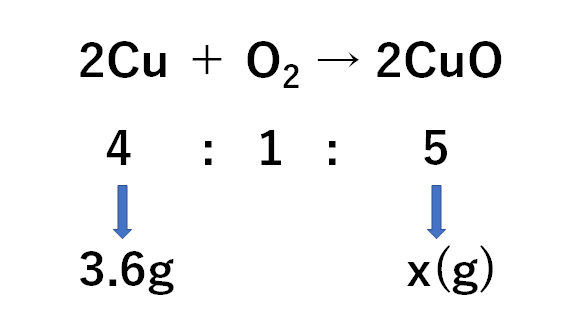
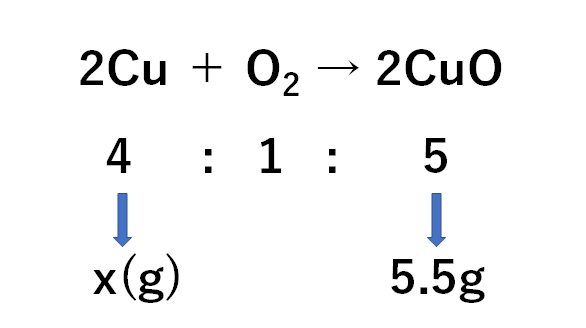
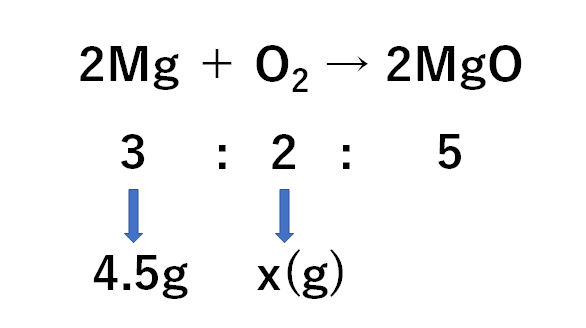
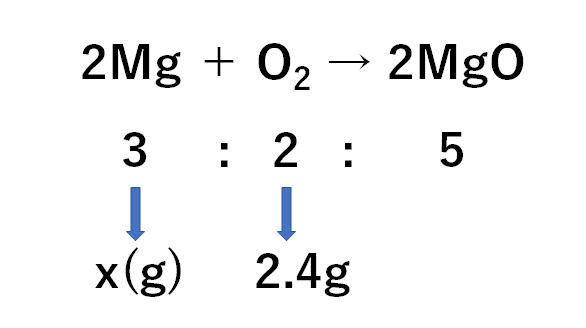



コメント(承認された場合のみ表示されます)
今回始めて見させていただきました。とてもわかりやすくて勉強になりました!
R君です様
コメントありがとうございます。
お役に立てたなら幸いです。
またいつでもご覧ください。
とてもわかりやすかったです!
MM様
コメントありがとうございます。
計算問題は大変ですが、がんばってくださいね。
またいつでもご覧ください。
こんばんは。1点教えてください。
解説中「酸化銅CuOは銅原子1個と酸素原子1個が結びついてできる」とありますが、なぜそうなるのでしょうか?
酸化銅は分子を作らないので、「1個1個が結び付いている」と言えるのでしょうか?
できたら解説よろしくお願いします。
ももか様
コメントありがとうございます。
返信が遅くなり大変申し訳ございません。
厳密にいえば、ももか様のおっしゃる通り、「酸化銅CuOは銅原子1個と酸素原子1個が結びついてできる」とは言えません。
正確には「酸化銅は銅原子1個と酸素原子1個が結びついたものが基本単位であり、これらが多数結びついている」と言うべきです。
ただその概念は中学生にはあまり必要がなく、簡易的な説明の方が伝わりやすいかと思い「酸化銅CuOは銅原子1個と酸素原子1個が結びついてできる」という説明をしています。