このページでは「蒸留とは何か」「純物質と混合物のちがい」などを解説しています。
動画による解説はこちら↓↓↓
チャンネル登録はこちらから↓↓↓
1.純物質と混合物
1種類の物質のこと。
水、酸素、二酸化炭素、鉄、エタノールなど。
2種類以上の物質が混ざったもの。
例として
・水溶液・・・水と溶質の混合物。
・空気 ・・・窒素と酸素とその他の気体の混合物。
・合金 ・・・2種類の金属を混ぜ合わせたもの。
・石油 ・・・ガソリン、灯油、軽油などの混合物。
・みりん・・・水とエタノールの混合物。
2.蒸留
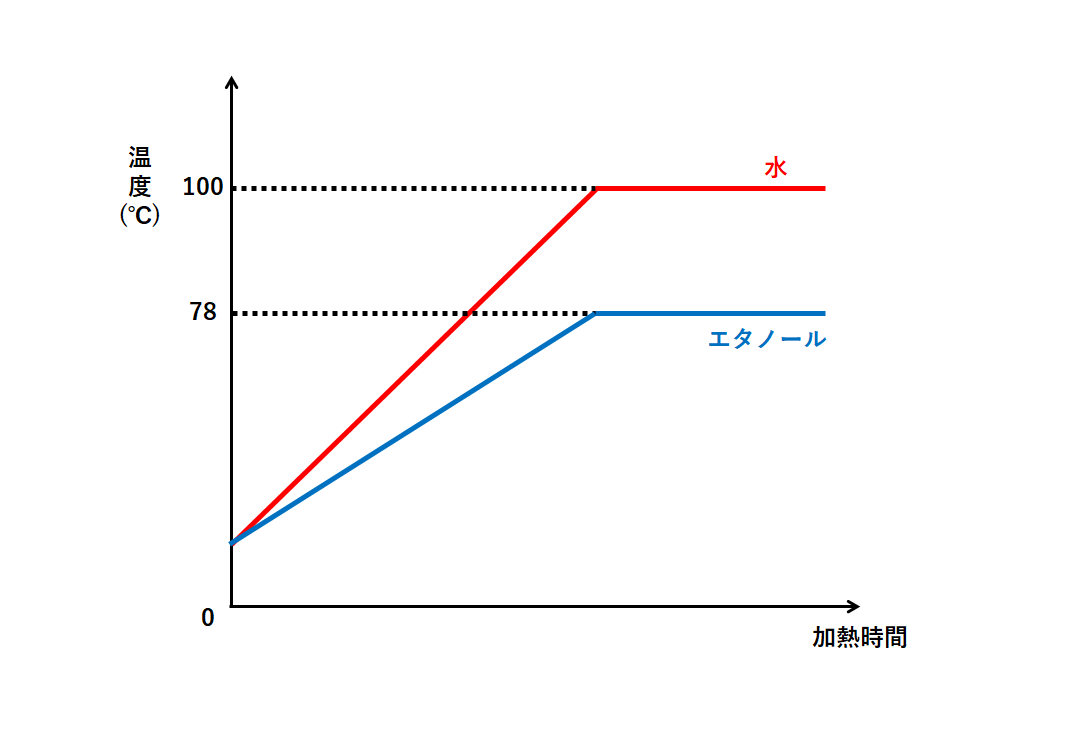
純物質を加熱すると、状態変化が起こったときに温度が上がらなくなります。(参考 →【状態変化】←)
例えば水やエタノールの液体を加熱するとしましょう。
水は沸点が100℃、エタノールは沸点が78℃。
その温度の変化は↓のようなグラフになります。
このように融点や沸点に達したとき、状態変化が終わるまで温度は上がりません。
では、混合物を加熱したときを考えます。
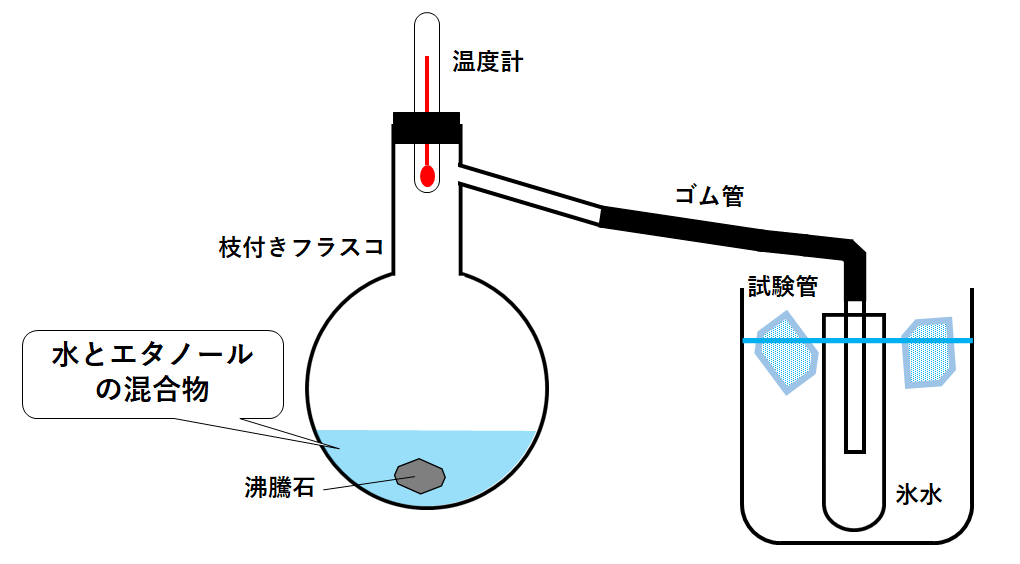
水とエタノールの混合物の加熱を考えます。
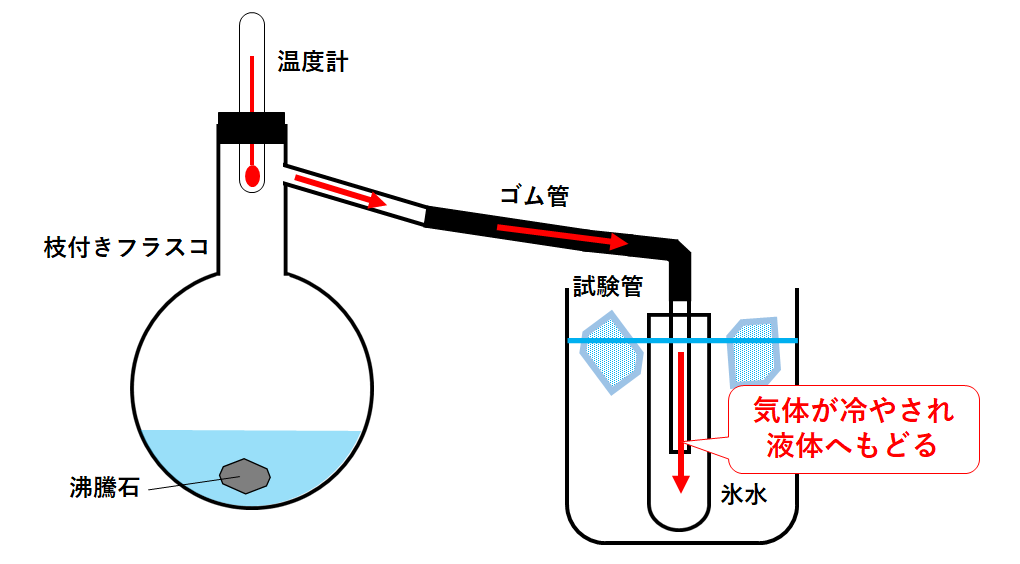
以下のような装置を使います。
枝付きフラスコの中に水とエタノールの混合物を入れて加熱します。
やがて水またはエタノールが沸騰します。(↓の図)
沸騰によって水やエタノールは液体から気体(蒸気)になります。
この蒸気はゴム管を通って右側の試験管にやってきます。
ビーカーには氷水が入っていますので、試験管に入った気体が冷やされます。
気体は液体へと戻ります(状態変化)。
つまり
・枝付きフラスコの中で液体が気体に変化
・試験管の中で気体が液体に変化
と状態変化が起こっています。
水とエタノールの混合物を加熱した場合、エタノールの沸点の方が78℃と低いので先に沸騰します。
はじめに試験管に集まる液体はエタノールが中心です。
その後加熱を続けると水が沸騰し、試験管には水が中心に集まります。
このようにすると水とエタノールを大まかに分けることが可能です。
沸点の違いを利用し混合物を分離するこの実験方法を蒸留と呼びます。
沸点の違いを利用して混合物を分離する方法。
※原油からガソリンや灯油を取り出すのに使われている。
3.蒸留のグラフ
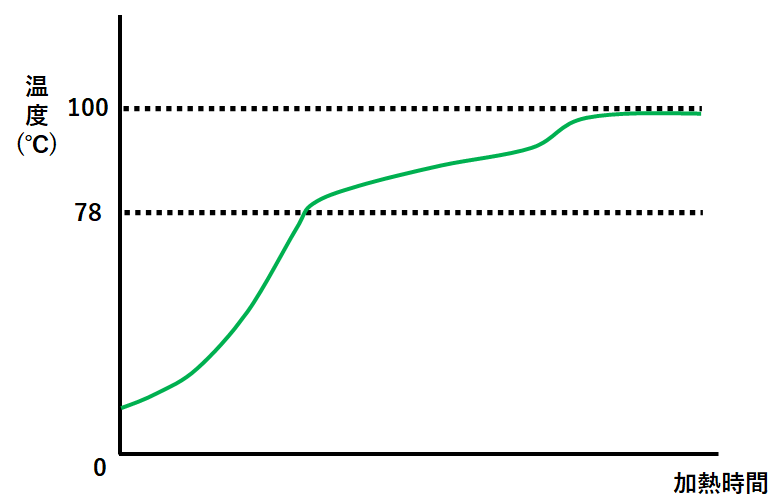
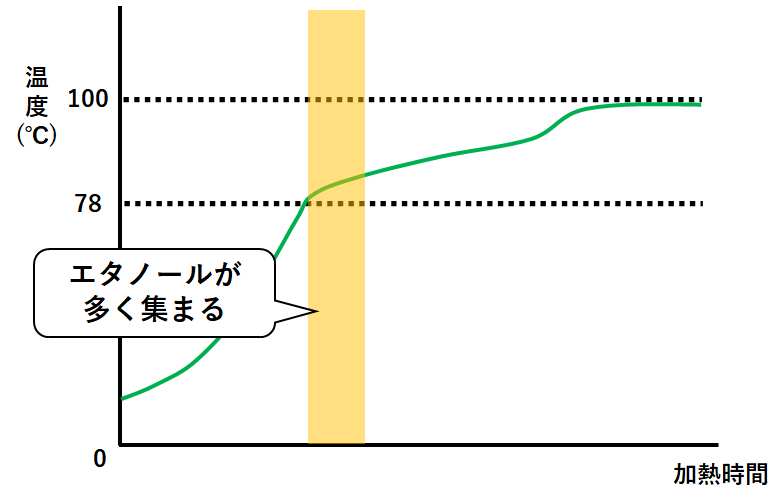
先ほどの装置の温度計で、温度の変化を測定すると↓のようなグラフになります。
純物質の場合とはちがい温度が一定になることがありません。
まずエタノールが沸騰。(同時に水が少しずつ蒸発しています。)
試験管にはエタノールと少量の水が集まることになります。(↓の図)
※純粋なエタノールではないことに注意。
本当にエタノールが集まっているかは
・特有のにおいがあるか(消毒薬やお酒のにおい)
・火を近づけて燃えるかどうか
を確かめればよいです。
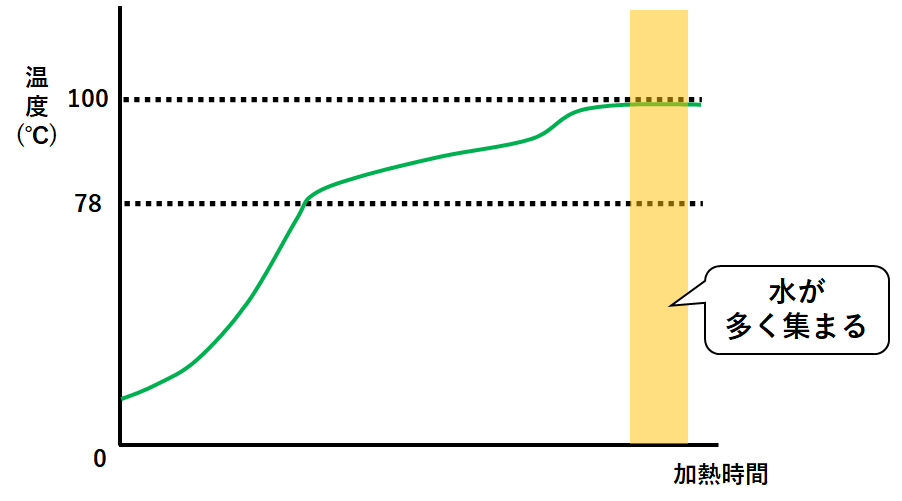
その後水が沸騰。
同時に残っていたエタノールが沸騰し続けています。
試験管には水と少量のエタノールが集まることになります。
※純粋な水でないことに注意。
このように蒸留では、混合物を“完全に”分離できるわけではないことを覚えておきましょう。
※蒸留を何度も繰り返し純度を高めることはできます。
4.蒸留の実験の注意点
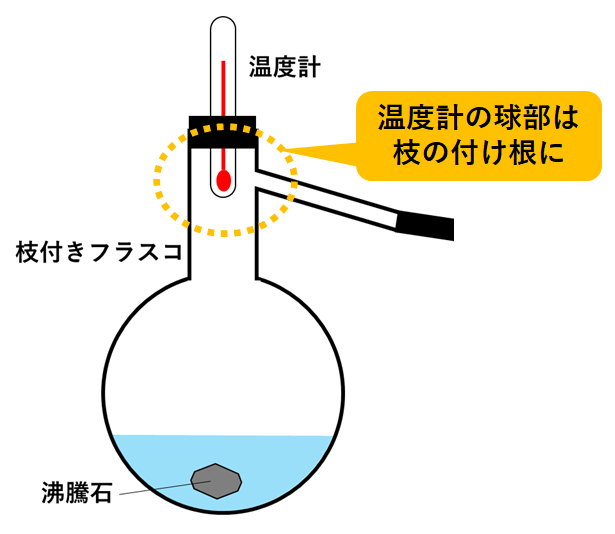
→液体の急な沸騰(突沸)を防ぐため。
※沸騰石として使えるのはレンガのかけらや素焼きのかけらなど。
→沸騰で生じた気体の温度を測定するため。
→試験管内の液体が逆流して枝付きフラスコが割れるのを防ぐため。
以上の記述問題はよく出ます!しっかり覚えておこう。


コメント(承認された場合のみ表示されます)
期末テストが迫っていて、今から覚えられるか不安だったけど、簡単かつ分かりやすく説明されていたので、とても助かりました!
にんげーん様
コメントありがとうございます。
お役に立てて何よりです。
またいつでもご覧ください。