このページでは「硫酸と水酸化バリウム水溶液の中和反応の計算問題」について解説しています。
沈殿が生じる場合の中和反応のくわしくは→【沈殿が生じる中和反応】←を参考に。
1.沈殿ができる場合の中和計算
考え方は→【中和の量的関係】←や→【気体の発生の計算】←のところと変わりません。
まず酸とアルカリがどのような比で混ぜ合わせたときに中性になるのかを必ず調べます。
(問題文・グラフ・表をチェック)
その比に基づいて計算を行っていきます。
では次のような例題を見てみましょう。
例題1
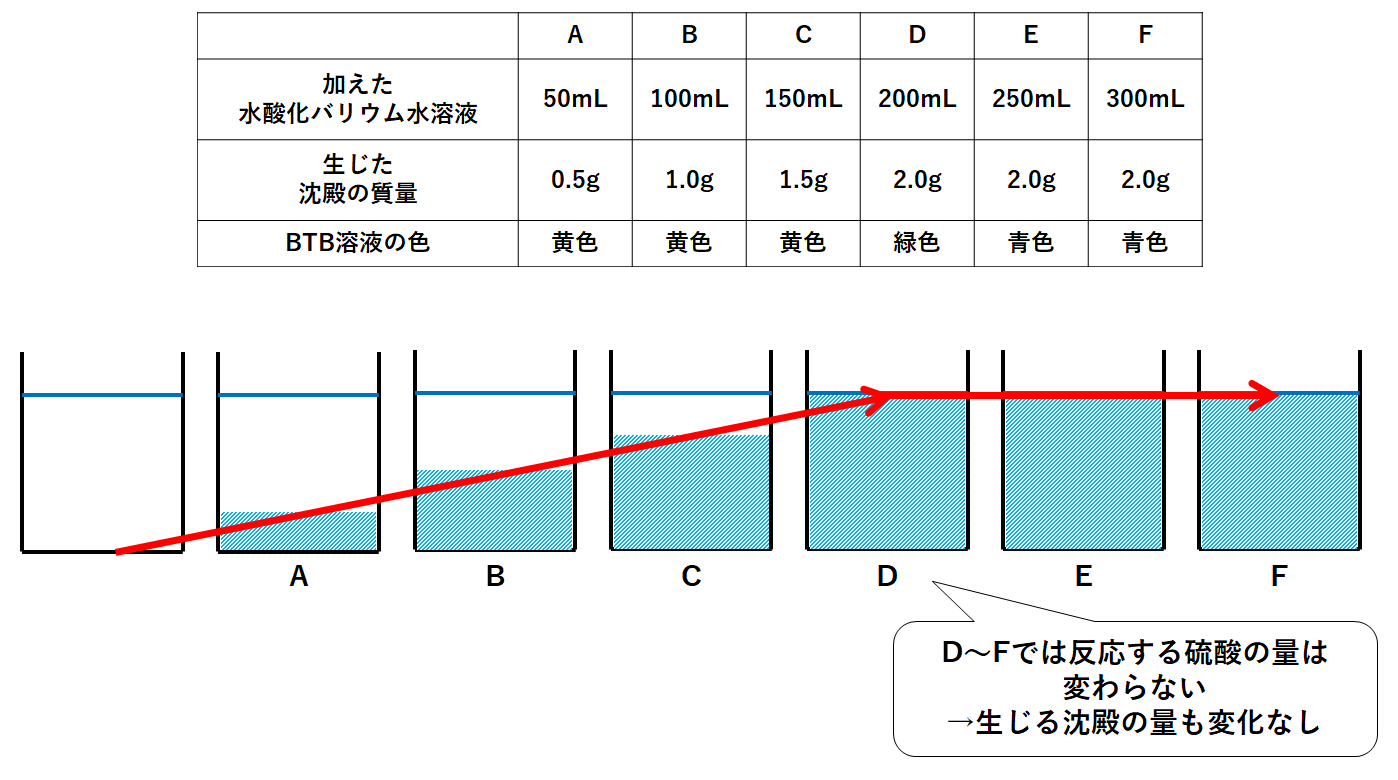
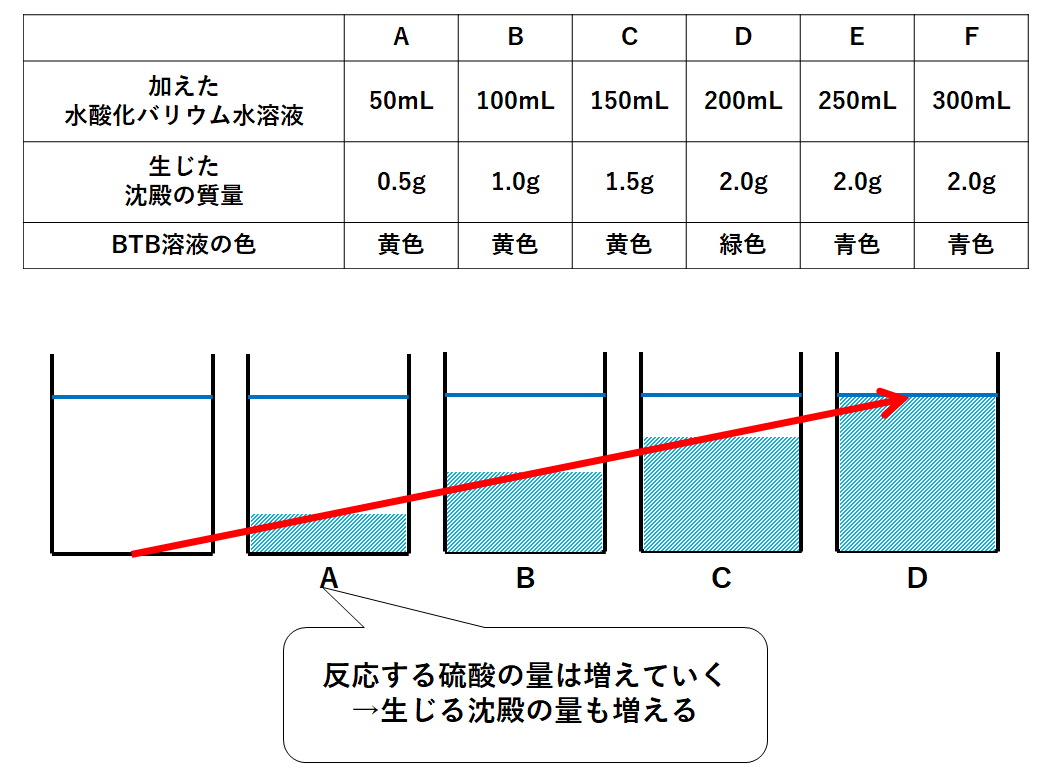
ここにBTB溶液を数滴加えると黄色になった。
その後、水酸化バリウム水溶液を50mLずつ加えていくと、溶液の色が変化し、また白色の沈殿が観察できた。
水酸化バリウム水溶液を合計300mL加えるまで色の変化と白色沈殿の質量を測定した。
次の表はその結果を表したものである。
(1) 生じた沈殿は何か。物質名を答えよ。
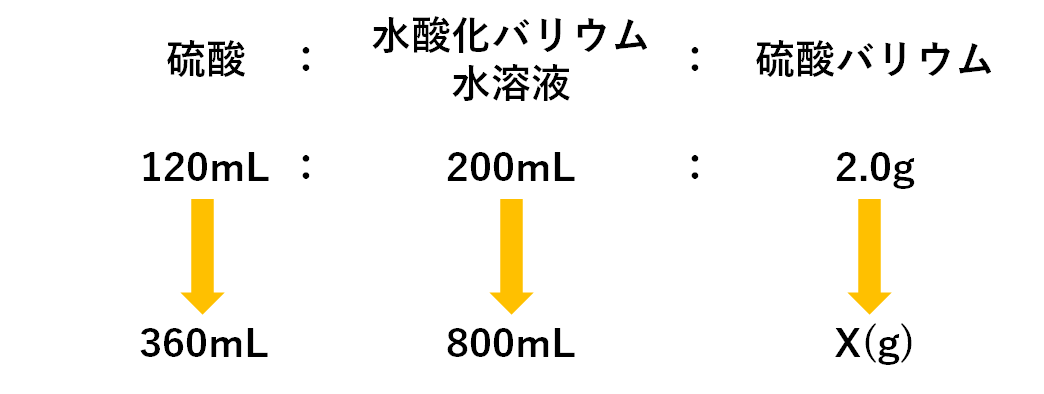
(2) 硫酸120mLを中性にするには水酸化バリウム水溶液が何mL必要か。またそのとき生じる沈殿は何gか。
(3) 硫酸360mLと水酸化バリウム水溶液800mL混ぜ合わせたときに生じる沈殿の量は何gか。
(答)
(1)
硫酸と水酸化バリウムの中和なので硫酸バリウムが生じています。
(2)
表中の「BTB溶液が緑色」に注目。
水酸化バリウム水溶液を200mL加えたときに中性になっています。
硫酸120mLと水酸化バリウム水溶液200mLで中性になるということです。
同じく表から、このとき硫酸バリウムの沈殿が2.0g生じることがわかります。
ということで次のような比になります。
(3)
→【中和の量的関係】← や →【定比例の法則(気体の発生)】← に書いてある「うどんのお話」を利用します。
求めたい沈殿(硫酸バリウム)の質量をX(g)とし、問題で聞かれていることをまとめると・・・
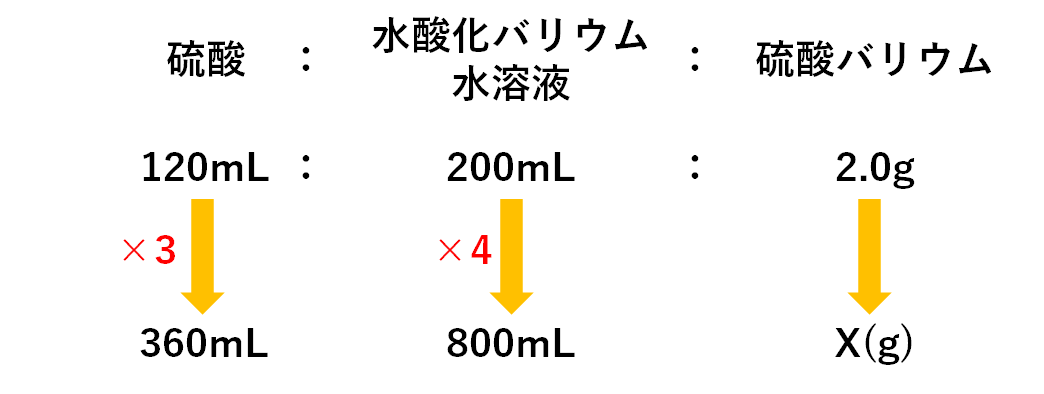
もとの比に対して硫酸は3倍、水酸化バリウム水溶液は4倍あります。
水酸化バリウム水溶液が多すぎるので、一部余ることがわかります。
一方で硫酸はすべて余ることなく反応するので、
X=2.0×3=6.0g
ということがわかります。
よって生じる沈殿(硫酸バリウム)は6.0gとなります。
ここで表をもう一度見てみましょう。
A~Dまでの間では沈殿の量が増えています。
それは加える水酸化バリウム水溶液の体積を2倍、3倍・・・と増やしていくと、反応する硫酸も2倍、3倍・・・と増えていくためです。(↓の図)
D~Fまでの間は沈殿の量が変化していません。
それはDで硫酸と水酸化バリウム水溶液が過不足なく反応しているためです。
硫酸120mLを中性にするには水酸化バリウム水溶液200mLで十分です。
これ以上水酸化バリウム水溶液を加えても、中和は起こらないため、生じる沈殿(硫酸バリウム)はこれ以上増えません。(↓の図)
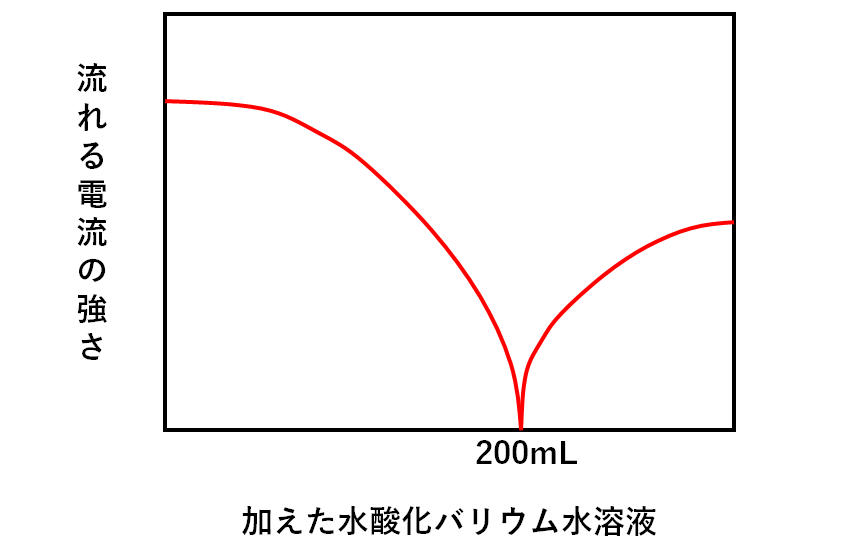
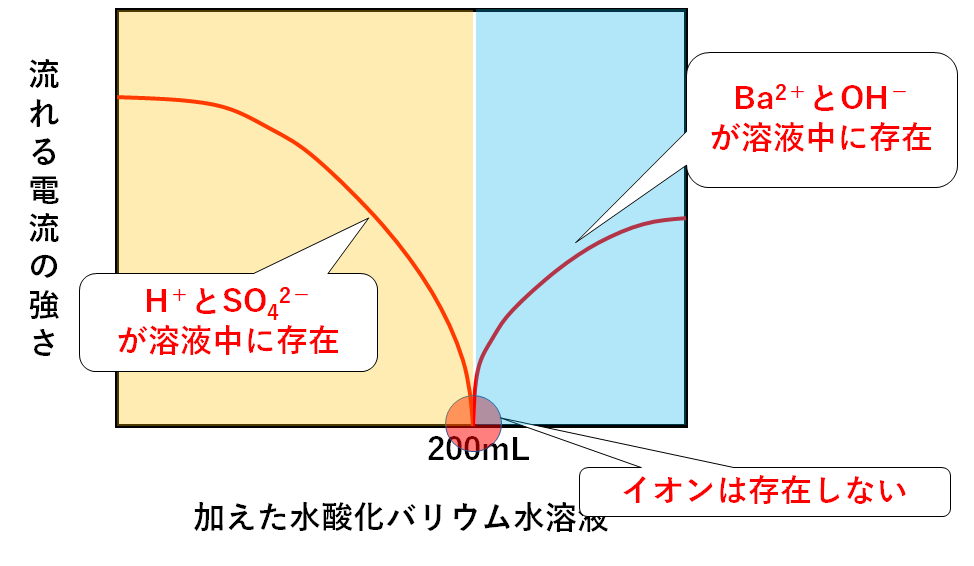
次にA~Fの各溶液が電流をどれだけ通すか、グラフに表すと↓のようになります。
※→【沈殿が生じる中和反応】←を参考に。
加えた水酸化バリウム水溶液が200mLのときが中性です。
このとき、電流は全く流れません。
というのは、イオンが存在しないからです。(↓の図)
硫酸の電離によって生じる2つのイオン( H+と SO42-)のうち
・H+はOH-と結びついてH2Oになる
・SO42-はBa2+と結びつき沈殿BaSO4(硫酸バリウム)になる
ためイオンは存在しないのです。
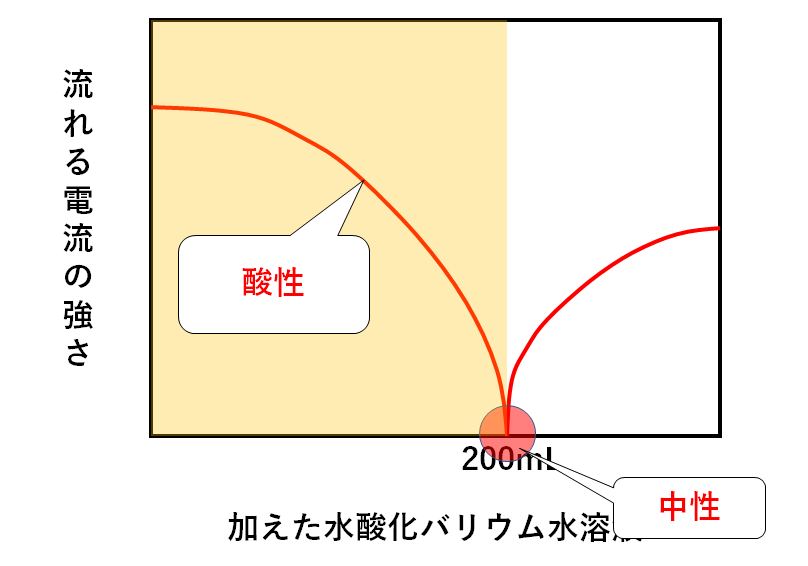
一方で加えた水酸化バリウム水溶液が200mL未満のときを考えましょう。
硫酸120mLを中性にする量には足りないことになります。
つまりこのときの溶液は酸性です。(↓の図)
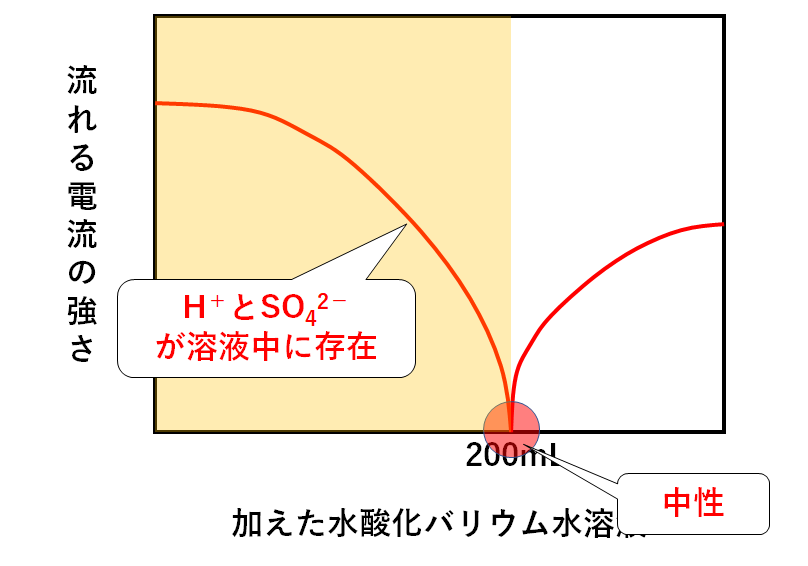
このとき、硫酸がまだ反応せず残っています。
すなわち H+と SO42-が溶液中に存在します。
一方他のイオンは・・・
・OH-はH+と結びついてH2Oになる
・Ba2+はSO42-と結びつき沈殿BaSO4(硫酸バリウム)になる
のでBa2+やOH-は溶液中に存在しません。(↓の図)
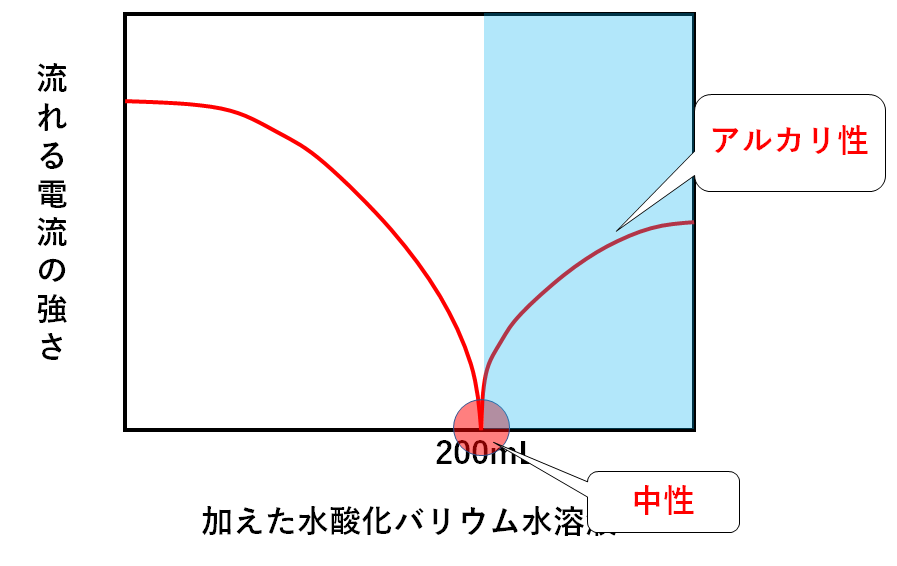
一方で加えた水酸化バリウム水溶液が200mLより多いときを考えましょう。
硫酸120mLを中性にする量には多すぎることになります。
つまりこのときの溶液はアルカリ性です。(↓の図)
このとき、余った水酸化バリウム水溶液が残っているのでBa2+やOH-が溶液中に存在します。
一方で
・H+はOH-との反応によってH2Oになる
・SO42-はBa2+と結びつき沈殿BaSO4(硫酸バリウム)になる
のでH+やSO42-は溶液中に存在しません。(↓の図)
まとめると↓のようになります。
このように表やグラフをしっかり読み取れる力を養っておきましょう。




コメント(承認された場合のみ表示されます)
管理人様
水酸化バリウム水溶液を200ml以上加えたときのグラフのすぐ下の文章が
「硫酸がまだ残っているので」とありますが,正しくは
「水酸化バリウムがまだ残っているので」ではないでしょうか?
何卒ご確認の程,よろしくお願い申し上げます。
神林さくら様
コメントありがとうございます。
ご指摘の通りです、修正させていただきました。
ありがとうございました。