中学校で学習する電気分解は
の2つが中心です。
水の電気分解も出題はされますが、詳しい原理まで問われることは珍しいです。(解説は→こちら←)
とはいえ、難しめの入試問題では、水の電気分解はもちろん、食塩水の電気分解、硫酸銅水溶液の電気分解など学校ではあまり習わないものも出題されることがあります。
ここでは、さまざまな水溶液の電気分解の考え方を紹介します。
1.電気分解の基本原理
電気分解というのは、水溶液に電流を通すことで物質が分解されること。
(分解は、1種類の物質から2種類以上の物質ができる化学変化)
電流の正体とは電子でした。
(そのあたりの話は→【放電】←で解説しています。)
その電子の動きをつくっているのは電源装置や電池です。
よって電気分解では
水溶液に電源装置をつないで、無理やり電子を動かす
ということが起こっています。
その結果、陽極や陰極において、電子が得られたり失ったりという
「電子が関係した反応」
が起こることになります。
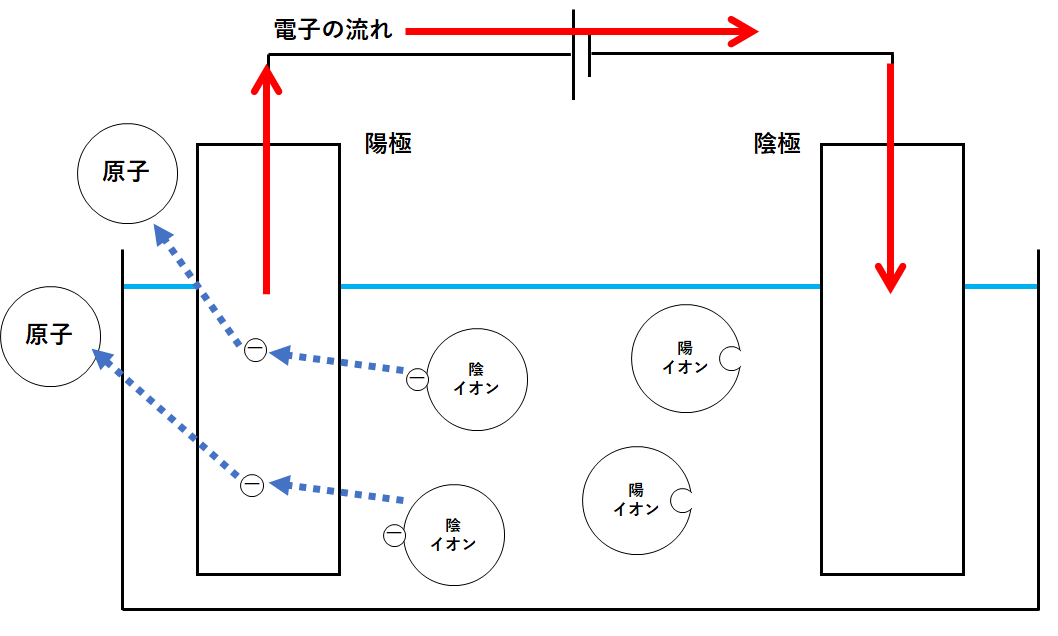
電解質が溶けた水溶液に電源装置をつなぎ、スイッチをONにすると↓のように電流が流れます。
電流の正体は電子です。
電流の流れと電子の流れは互いに逆向きでした。(中2で学習)
そのため↓のように電子が動かされることになります。
陽極では、液中の誰かから電子をもらいます。
その電子が電源装置によって、
陽極→導線→電源装置→導線→陰極
へと運ばれます。
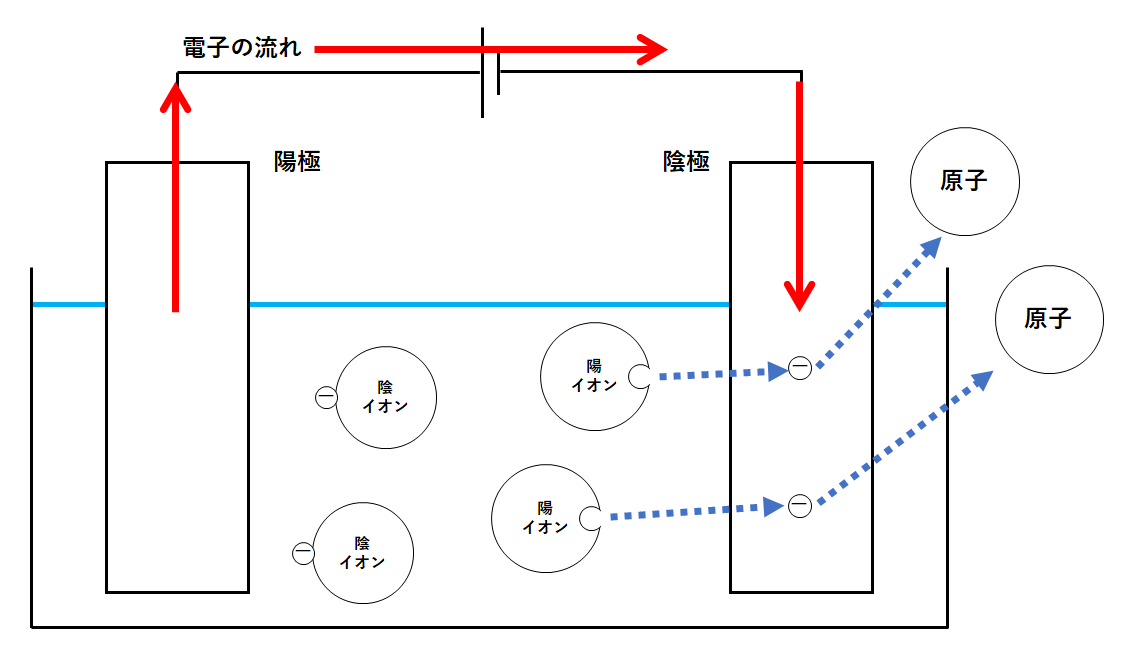
陰極にどんどん電子がたまっていくのです。
このときたまった電子を処理するのに、液中のイオンに持っていってもらうのです。
陽極では、液中の陰イオンから電子をもらいます。
陰イオンは電子を失うことになります。
そして陰イオンは原子になってしまいます。(↓の図)
陰極では、液中の陽イオンが電子を持っていってくれます。
陽イオンは電子を得ることになります。
そして陽イオンは原子になります。
※補足
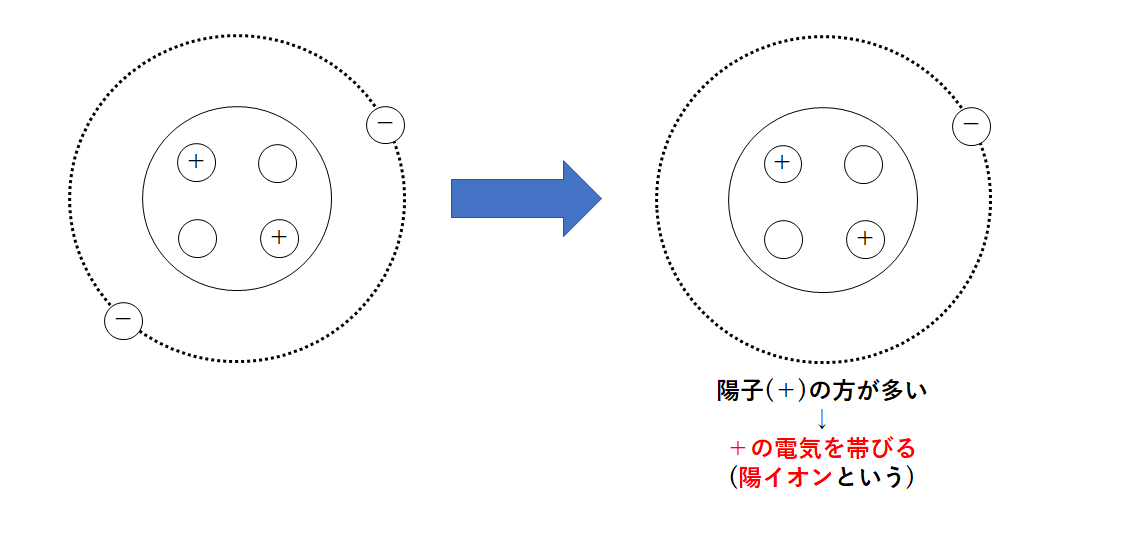
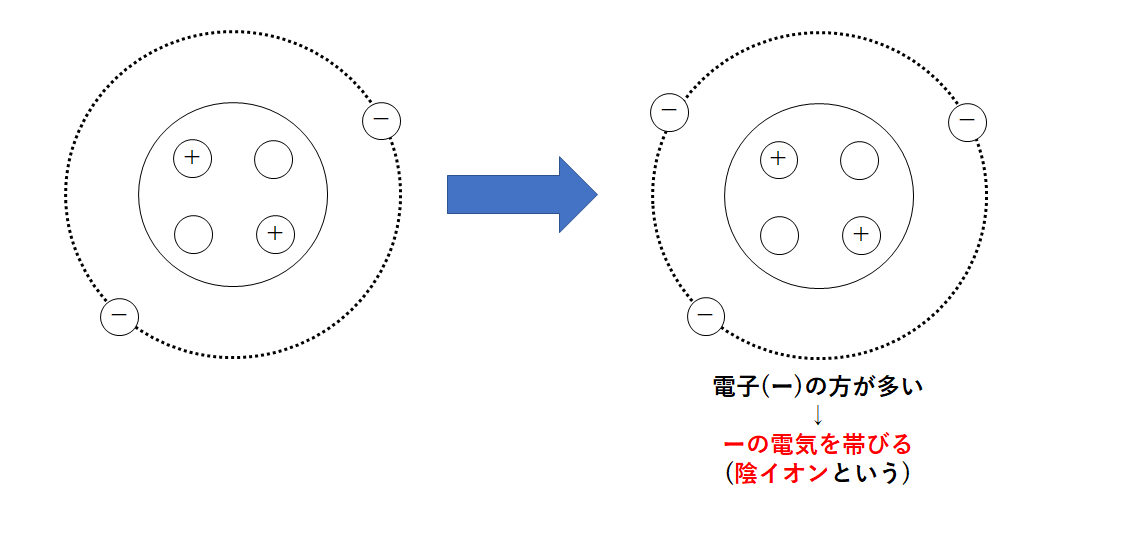
イオンは原子が変化したもの。
原子は「+の電気の数=-の電気の数」となっている。
そして
原子が電子(-の電気)を失った・・・+の電気の方が多くなるので陽イオンとなる。
原子が電子(-の電気)を得た・・・・-の電気の方が多くなるので陰イオンとなる。
ということです。
このあたりの話は→【イオンとは】←で解説しています。
POINT!!
電気分解の基本原理を押さえておこう!
電気分解とは、電源装置によって電子を無理やり動かすことで起こる。
陽極では・・・陰イオンが電子を失って、原子になる。
陰極では・・・陽イオンが電子を得て、原子になる。
2.電気分解で生じるもの
では、陽極や陰極ではどのような物質が生じるのかを考えましょう。
どのような物質が生じるかは、ある程度規則性があります。
その規則性は、溶けている物質(溶質)から電離して生じるイオンによります。
陰極と陽極のそれぞれについて紹介します。
陽極の場合
先述の通り、次のような反応が起こりますね。
① 液中に塩化物イオンCl-がある場合
塩化物イオンCl-が電子を失い、塩素原子Clとなります。
その結果、塩素の気体Cl2が発生します。
式で書くと
2Cl- → Cl2 + 2e-
(e-は電子のこと。)
②液中に水酸化物イオンOH-がある場合
水酸化物イオンOH-が電子を失います。
その結果、酸素の気体O2が発生します。
式で書くと
4OH-→ O2 + 2H2O + 2e-
③液中にCl-もOH-もない場合
この場合、液中にSO42-やNO3-などがあることが多いです。
これらはさまざまな原子が集まってイオンになっています。(多原子イオンという)
だから重たい、そのため動きにくい。
よって反応に関与しないと覚えておきましょう。
では陰極はだれから電子をもらうのでしょうか。
・・・
答は水H2Oです。電子を持っていそうなのは水しかありません。
水分子H2Oが電子を失います。
(水は陰イオンではないので、まさに”無理やり”引き起こしている反応です。そのため、そんなに起こりやすい反応ではありません)
その結果、酸素の気体O2が発生します。
式で書くと
2H2O → 4H+ + O2 + 2e-
まとめると↓のようになります。
POINT!!
電気分解において、陽極側で発生する物質は・・・
① 液中にCl-がある・・・塩素の気体Cl2発生
② 液中にCl-がない・・・酸素の気体O2発生
陰極の場合
先述の通り、次のような反応が起こりますね。
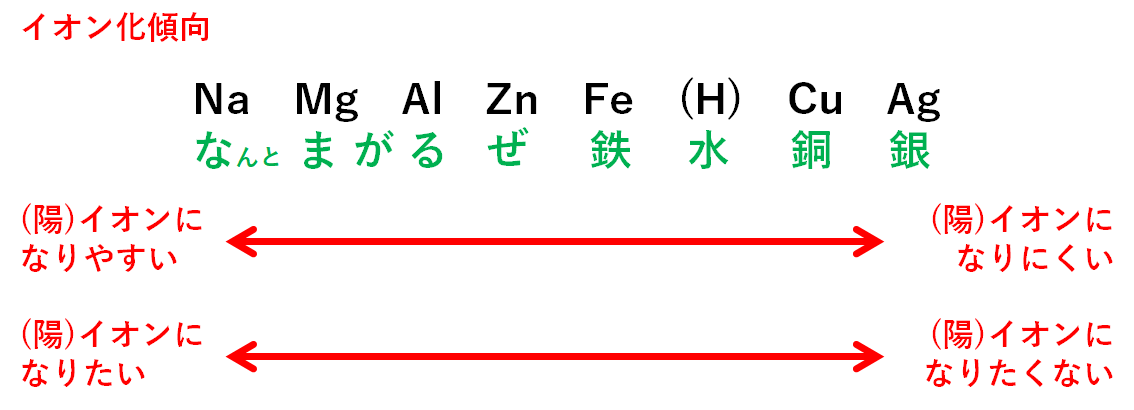
陰極では「イオン化傾向」というものが関係してきます。
イオン化傾向とは「どれだけイオンになりやすいか・なりにくいか」を表します。
中学では、次の8つについて覚えておくとよいでしょう。
(どれも陽イオンになるものばかりです。)
ちなみに高校ならば、次を覚えておく必要があります。
電気分解の話にもどります。
①液中に水素Hよりイオン化傾向が大きいイオンがあるとき
イオン化傾向が大きい=できるだけイオンのままでいたい
ということです。
つまりイオン化傾向の大きいイオンには何も起こりません。
一方で水素イオンH+は
イオン化傾向が小さい=できるだけイオンでいたくない
ということです。
よって陰極から電子を得て、水素原子にもどります。
その結果、水素の気体H2が発生します。
式で書くと
2H++2e-→H2
②液中に水素Hよりイオン化傾向が小さいイオンがあるとき
イオン化傾向が小さい=できるだけイオンでいたくない
ということです。
イオンでいたくないので、原子にもどろうとします。
一方で水素イオンH+は、それに比べて
イオン化傾向が大きい=できるだけイオンのままでいたい
ということです。
よって水素イオンH+には何も起こりません。
したがってイオン化傾向の小さなイオンが、陰極から電子を得て原子にもどります。
銀イオンAg+ならば、陰極から電子を得て、銀原子Agになります。
式で書くと
Ag++ e-→ Ag
銅イオンCu2+ならば、陰極から電子を得て、銅原子Cuになります。
式で書くと
Cu2++ 2e-→ Cu
まとめると↓のようになります。
POINT!!
電気分解において、陰極側で生じる物質は・・・
① 液中にHよりイオン化傾向が大きいイオンがあるとき
・・・水素の気体H2が発生
② 液中にHよりイオン化傾向が小さいイオンがあるとき
・・・そのイオンが原子となる
3.ここまでのまとめ
陽極では・・・
陰イオンが電子を失って、原子になる。
① 液中にCl-がある・・・塩素の気体Cl2発生
② 液中にCl-がない・・・酸素の気体O2発生
陰極では・・・
陽イオンが電子を得て、原子になる。
① 液中にHよりイオン化傾向が大きいイオンがあるとき
・・・ 水素の気体H2が発生
② 液中にHよりイオン化傾向が小さいイオンがあるとき
・・・ そのイオンが原子となる
※以上の電気分解は、電極が白金や炭素のとき
中学生の人にとってはやや難しいかもしれません。
しかし、以上の原理を理解していると、丸暗記に頼らずにすみますし、このことを覚えていると高校でも役立ちます。
せひがんばってみてください。




コメント(承認された場合のみ表示されます)