原子とは物質をつくる最も小さい粒子。
でもその種類を表す記号は元素記号・・・。
原子と元素って何が違うのでしょうか。
これは高校化学でも教えてもらう内容なのですが、カンタンに説明してみます。
※原子について中2で習うことは→【原子・分子】←にまとめています。よければどうぞ。
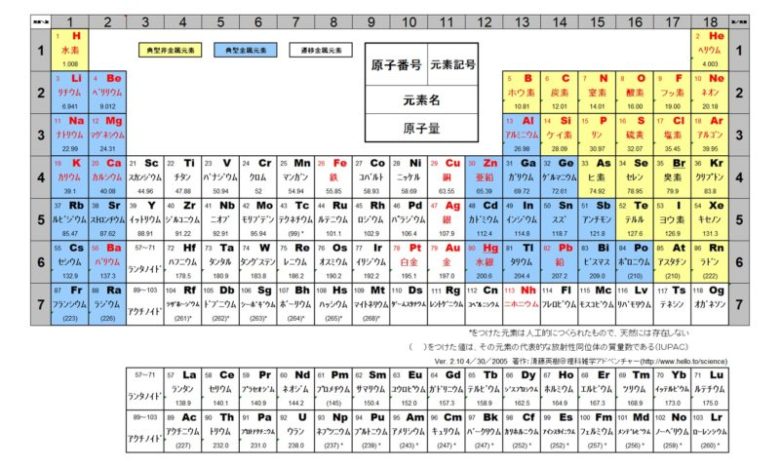
原子の構造と周期表
原子は100種類以上存在します。
周期表では順番に
水素・ヘリウム・リチウム・ベリリウム・ホウ素・炭素・窒素・・・
と並んでいますね。
この順番(原子番号)には意味があります。
原子の構造は次の図のようになっています。
しかし原子の種類によって陽子の数や電子の数が異なります。
(↑の図はヘリウム原子の構造)
周期表とは
陽子の数の順番にならんでいる
ものなのです。
言い換えると
原子番号=陽子の個数
となります。
POINT!!
原子番号=陽子の個数!
ちなみに原子においては
陽子の個数=電子の個数
となっています。
これにより原子は
電気的に中性である(+でも-でもない)
という状態です。
同位体とは
一方で、中性子。
なかなか中学校では話題になりませんが・・・
実は中性子の数は同じ種類の原子でも異なる場合があります。
例えば水素原子。
水素原子には3種類あります。
①中性子の数が0個のもの
②中性子の数が1個のもの
③中性子の数が2個のもの
これら①~③はどれも同じ水素原子であり、性質は変わりません。
しかし質量は少しずつ違ってきます。
このように陽子の数は同じだけど、中性子の数が異なるものを同位体(別名:アイソトープ)といいます。
POINT!!
同位体とは、陽子の数は同じだが、中性子の数が異なるもの。
同位体には安定したものと不安定なもの(=放射性同位体)があります。
炭素原子の安定な同位体は2つで
①中性子が6個のもの
②中性子が7個のもの
があります。
このように炭素原子、といっても同位体が存在するのですが、中学校ではこの2つを区別しません。
原子はこのように1個1個の粒なので、本来は中性子の数が異なれば区別する必要があります。
一方でどちらも「炭素」という種類は同じ。
このように種類を表す言葉を元素といいます。
元素が同じでも、まったく同じ粒なのかと言われると違うこともあるわけですね。
ということで「原子」と「元素」の言葉の違いは、以上のようにまとめられます。
原子・・・1個1個のとても小さな粒のこと。
元素・・・原子の種類のこと。
※原子について中2で習うことは→【原子・分子】←にまとめています。よければどうぞ。


コメント(承認された場合のみ表示されます)