このページでは鉄の精錬・酸化鉄を還元して鉄を得る方法について解説しています。
やや発展的な内容です。
高校の化学でも学習する内容です。
1.鉄の精錬
鉄は日常生活において非常によく使われている金属です。
自然界において、鉄は鉄のまま存在しているわけではありません。
地球(地殻やマントルも含め)には約35%の鉄原子が含まれます。
これらは酸化鉄として自然界に存在します。
では、その酸化鉄はどこにあるのか?と言うと鉄鉱石の中にあります。
鉄鉱石(酸化鉄)には2種類あります。
1つは化学式で Fe2O3 と書かれる赤鉄鉱。
もう1つは、化学式で Fe3O4 と書かれる磁鉄鉱。
現代では、赤鉄鉱Fe2O3 を使って製鉄(鉄を取り出す)のが主流です。
鉄の精錬の仕組み
ではその仕組みを見ていきましょう。
赤鉄鉱Fe2O3から鉄Feを取り出すには還元の化学変化を利用します。
※還元の化学変化の詳しくは→【還元】←にて。
中学で学習する還元と言えば
酸化銅の炭素による還元
が真っ先に浮かびます。
赤鉄鉱Fe2O3から鉄Feを還元するのにも、炭素Cを利用します。
実際には炭素のままではなく、一酸化炭素COに変えてから還元反応を起こします。
赤鉄鉱Fe2O3の還元には、溶鉱炉を利用します。
溶鉱炉に赤鉄鉱Fe2O3とコークスを入れます。
※コークスとは石炭を乾留(蒸し焼きのこと)し、炭素のみにしたもの。
要は炭素Cだと思ってください。
他にも石灰石CaCO3を入れておきます。
溶鉱炉で起こる反応
まず溶鉱炉では炭素Cが燃焼します。
C + O2 → CO2 ・・・① (炭素の(完全)燃焼)
また石灰石が熱風により分解されます。
CaCO3 → CaO + CO2 ・・・② (石灰石の分解)
①②で生じた二酸化炭素CO2はコークスCと反応し、一酸化炭素COへと変化します。
CO2 + C → 2CO ・・・③
③で生じた一酸化炭素COが赤鉄鉱Fe2O3の還元に使われます。
このとき赤鉄鉱Fe2O3は段階的に還元されます。
まず Fe2O3 から Fe3O4 へと還元。
次に Fe3O4 を FeO へと還元。
最後に FeO を Fe へと還元。
※補足
Fe2O3 → Fe3O4 → FeO という流れが本当に還元なのか確かめておきましょう。
段階的に還元が起こる=少しずつ酸素が失われる、ということ。
本当に少しずつ酸素が失われているかチェックします。
Fe2O3におけるFe原子とO原子の数の比は
Fe:O=2:3=1:1.5
Fe3O4におけるFe原子とO原子の数の比は
Fe:O=3:4=1:約1.3
FeOにおけるFe原子とO原子の数の比は
Fe:O=1:1
Fe原子1個あたりに結びつくO原子の数が
1.5個 → 約1.3個 → 1個
と少しずつ減少しています。
すなわち段階的に還元されていることになります。
まず Fe2O3 から Fe3O4 へと還元される反応は
3Fe2O3 + CO → 2Fe3O4 + CO2 ・・・④
※Fe2O3が還元され、一方でCOは酸化されてCO2へと変化。
次に Fe3O4 から FeO へと還元される反応は
Fe3O4 + CO → 3FeO + CO2 ・・・⑤
※Fe3O4が還元され、一方でCOは酸化されてCO2へと変化。
最後に FeO から Fe へと還元される反応は
FeO + CO → Fe + CO2 ・・・⑥
※FeOが還元され、一方でCOは酸化されてCO2へと変化。
④と⑤をまとめます。
連立方程式の加減法のように
⑤の両辺を2倍したものと④とを足してみます。
Fe3O4の係数をそろえるのです。
以上から
Fe2O3 + CO → FeO + CO2 ・・・⑦
という反応式が得られました。
次に⑥の両辺を2倍したものと⑦を足します。
FeOの係数をそろえます。
以上から次の反応式が得られます。
Fe2O3 + 3CO → 2Fe + 3CO2・・・⑧
この⑧式が④~⑥をまとめたものになります。
このようにして溶鉱炉の中で鉄Feができます。
溶鉱炉でできた鉄には炭素が混ざっており、硬くてもろい、という性質を持ちます。
(少し力を加えただけでくずれて、金属本来の性質である展性・延性がない)
このような鉄を銑鉄(せんてつ)といいます。
最後に銑鉄から炭素を取り除き、鉄の純度を上げていかなければなりません。
そのために転炉(てんろ)というところに銑鉄を入れます。(銑鉄は融解しておく)
そこに酸素を吹き込み、炭素を酸化します。
こうすることで、銑鉄から不純物である炭素を取り除きます。
このとき得られた、純度の高い鉄を特に鋼(こう)といいます。
以上のような仕組みで、鉄鉱石から鉄を取り出します。
まとめ
溶鉱炉の中に酸化鉄Fe2O3、コークスCを入れて以下の式のような反応を起こす。
3Fe2O3 + CO → 2Fe3O4 + CO2
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
この結果、得られた鉄は炭素をふくんでいる。
これを銑鉄といい、もろい。
そのため、転炉で酸素を吹き込んで、混ざっている炭素を酸化する。
このようにして純度の高い鉄を得る。
POINT!!
・鉄の単体は自然界にはあまり存在しない。
・鉄鉱石中の酸化鉄をコークスで還元して、鉄の単体を得る。
・中学生ならば、このページの化学反応式までは覚える必要はないと思います。おおよその反応の流れだけ知っておくとよいでしょう。

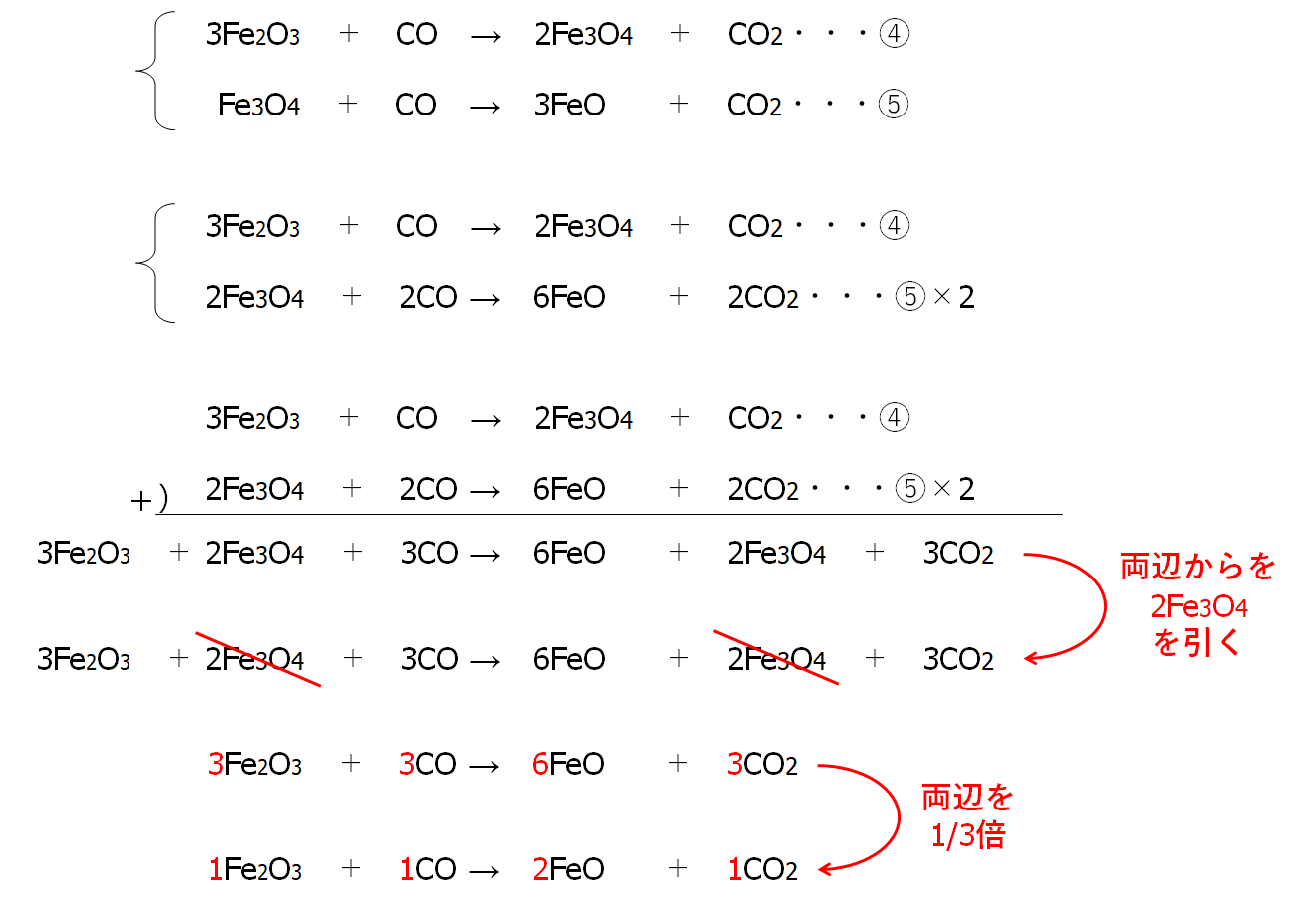
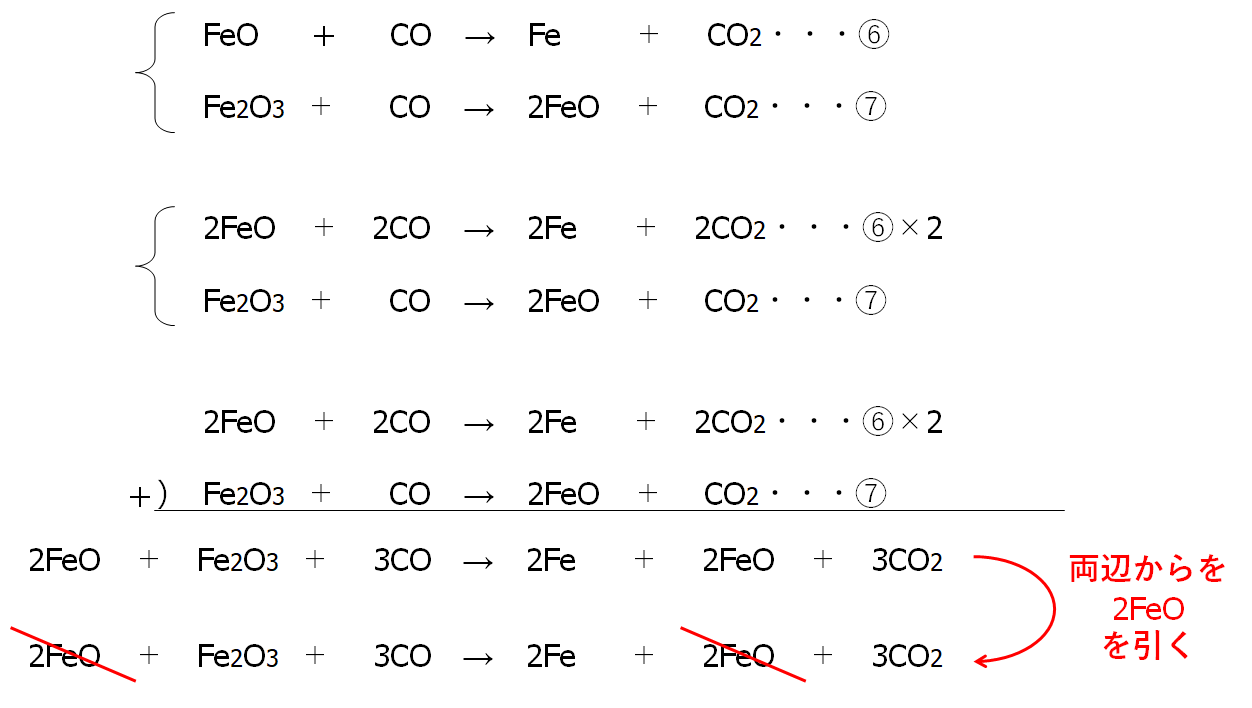
コメント(承認された場合のみ表示されます)
還元に、水素は使えないのですか?
天照様
コメントありがとうございます。
還元に水素を使うことは可能です。(CuO+H2→Cu+H2O)
どれほど実用化されているかはわかりませんが、水素を使った鉄の精錬も研究されているようです。
返信ありがとうございます!
わかりました!
また何かあったら頼らせていただきます!
古いコメントだけど一応書いておきます。
今の高炉は二酸化炭素を減らす為に、水素も吹き込んでいます。
ただ水素による還元は吸熱反応で、
水素の量を増やすと炉の温度が下がって、うまく還元出来なくなってしまいます。
なので今は、水素の量を増やしても炉の操業に影響がない仕組みが研究されています。
通りすがり様
コメントありがとうございます。
なるほど水素の活用が進んでいるのですね。
ご教授ありがとうございます。
私の方でも詳しく調べてみます!