このページでは「銅の酸化」「マグネシウムの酸化」「有機物の燃焼」などについて解説しています。
酸化についての計算問題は→【定比例の法則(酸化)】←を参考に。
動画による解説は↓↓↓
チャンネル登録はこちらから↓
1.酸化
■酸化
物質が酸素と化合すること。
■酸化物
酸素が化合してできた物質。
■燃焼
熱や光をともなうはげしい酸化。
(例)銅の酸化
(反応の様子) 銅 + 酸素 → 酸化銅
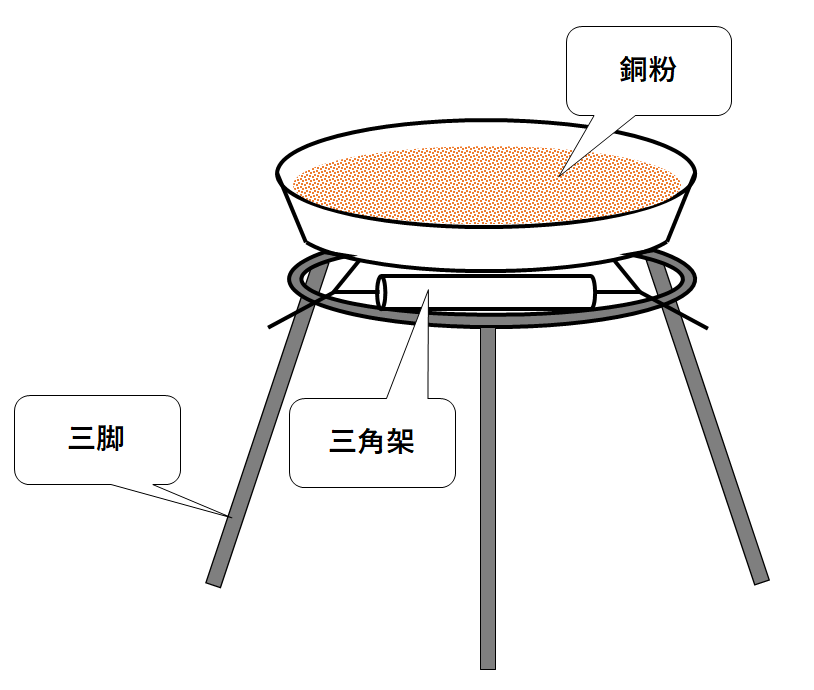
銅(赤色または赤褐色)の粉末をステンレス皿に入れて加熱すると、やがて黒ずんでいき酸化銅(黒色)が生じます。
これは空気中の酸素が銅と結びついた(=酸化)ためです。
・銅と酸化銅ではまったく性質が異なります。
例) 銅には光沢がある。 ←→ 酸化銅にはない。
例) 銅は電気を通す。 ←→ 酸化銅は電気を通さない。
※銅と酸化銅のどちらも塩酸とは反応しません。注意。
・この実験のとき、ステンレス皿の銅の粉末をよくかき混ぜながら加熱します。
⇒ すべての銅が酸素とふれるようにし、完全に酸化させるためです。
(例2)マグネシウムの燃焼(酸化)
(反応の様子) マグネシウム + 酸素 → 酸化マグネシウム
マグネシウムの金属をガスバーナーで加熱すると明るい光を出しながら酸化していきます。
(酸化マグネシウムの生成)
このように熱や光をともなう酸化を燃焼といいます。
※銅の場合は熱や光をともなわないので「燃焼」とは呼びません。
・酸化物の多くは黒っぽい色ですが、酸化マグネシウムは白色です。例外的なのでよく出題されます。
・マグネシウムと酸化マグネシウムではまったく性質が異なります。
⇒ マグネシウムは塩酸と反応して水素が発生。 ←→ 酸化マグネシウムは塩酸と反応しない。
(例3)スチールウールの燃焼(酸化)
(反応の様子) 鉄 + 酸素 → 酸化鉄
鉄を細い線状にしたものをスチールウールといいます。
スチールウールをガスバーナーで加熱すると熱や光を出しながら酸化して酸化鉄になります。
つまり酸化の中でもとくに燃焼が起こっています。
・スチールウール=鉄ということを覚えておきましょう。
・鉄と酸化鉄ではまったく性質が異なります。
例) 鉄は塩酸と反応して水素が発生 ←→ 酸化鉄は塩酸と反応しない
例) 鉄は電気を通す ←→ 酸化鉄は電気を通さない。
例) 鉄は磁石に引き寄せられる。 ←→ 酸化鉄は引き寄せられない。
※金属がすべて磁石に引き寄せられるわけではありません。
※磁石に引き寄せられる金属は鉄・ニッケル・コバルトくらいです。
(例4)炭素の完全燃焼
(反応の様子) 炭素 + 酸素 → 二酸化炭素
木や木炭には炭素が含まれています。
加熱すると熱や光を出しながら酸化し、二酸化炭素になります。
(例5)*炭素の不完全燃焼
(反応の様子) 炭素+酸素→一酸化炭素
酸素が不足気味の状態での燃焼を「不完全燃焼」といいます。
炭素が不完全燃焼すると二酸化炭素ではなく、一酸化炭素になります。
・一酸化炭素は有毒な気体です。
※一酸化炭素は血液中のヘモグロビンと結びつきやすく、酸素の運搬をさまたげるためです。
(例6)水素の燃焼
(反応の様子) 水素 + 酸素 → 水
水素はマッチの火を近づけると音を立てて燃えましたね。
これは水素と酸素が結びつく、という反応です。
つまり水素の燃焼です。
・水は塩化コバルト紙の色を青色から赤色に変化させます。
(例7)有機物の燃焼
(反応の様子) 有機物 + 酸素 → 二酸化炭素 + 水
有機物は炭素原子を含む物質のことで、多くが水素原子も含みます。
そのため酸化(燃焼)させると、二酸化炭素と水が発生します。
有機物の例としては以下のようなものがあります。
天然ガス :メタン・エタン・プロパン
アルコール:メタノール・エタノール
糖類 :デンプン・ブドウ糖・砂糖
その他 :石油・石炭・ロウ・プラスチック
どれも燃焼すると水と二酸化炭素が生じます。
※→【有機物と無機物】←を参考に。
POINT!!
・酸化とは酸素と結びつくこと。
・燃焼とは熱や光をともなう酸化のこと。
・モノが燃える=モノが酸化されている、ということです。
・「何と何が反応して何が生じるのか?」をしっかり覚えること。


コメント(承認された場合のみ表示されます)