このページでは、塩酸の電気分解を例に「電気分解の原理とは」「陽極や陰極ではどのような変化が起こるのか?」を解説しています。
※できれば→【イオンとは】←や→【電離・電解質】←も参考に。
※塩化銅水溶液の電気分解の原理は→【塩化銅水溶液の電気分解】←を参考に。
※水の電気分解の原理は→【水の電気分解】←を参考に。
動画による解説は↓↓↓
チャンネル登録はこちらから↓↓↓
1.塩酸の電気分解
■分解
1つの物質が2つ以上の物質に変化する化学変化。
■電気分解
電気を通すことで行う分解。
電気エネルギーを化学エネルギーに変換している。
■塩酸
水に塩化水素(塩酸の溶質)を溶かした水溶液。
塩化水素は次のように電離する。
・ HCl → H+ + Cl-
■塩酸の電気分解
(反応の様子) 塩化水素 → 水素 + 塩素
(化学反応式) 2HCl → H2 + Cl2
2.塩酸の電気分解の仕組み
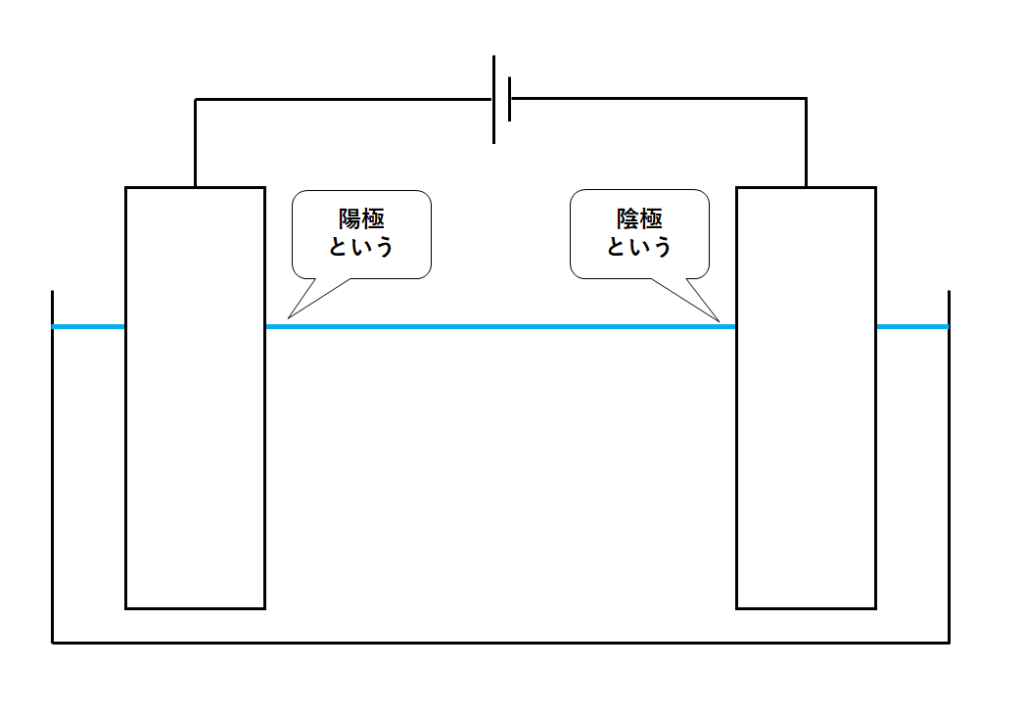
■陽極・陰極
電源の+極からつながっている電極が陽極。
電源の-極からつながっている電極が陰極。
電極には他の物質と反応しにくい炭素や白金を用いることが多い。
POINT!!
電気分解は、次のイメージを持っておこう!
→ 溶液に電気を流す。つまり溶液中の電子を動かす。
→ 溶液中のイオンが無理やり電子を受け渡しさせられて、原子にもどる反応のこと!
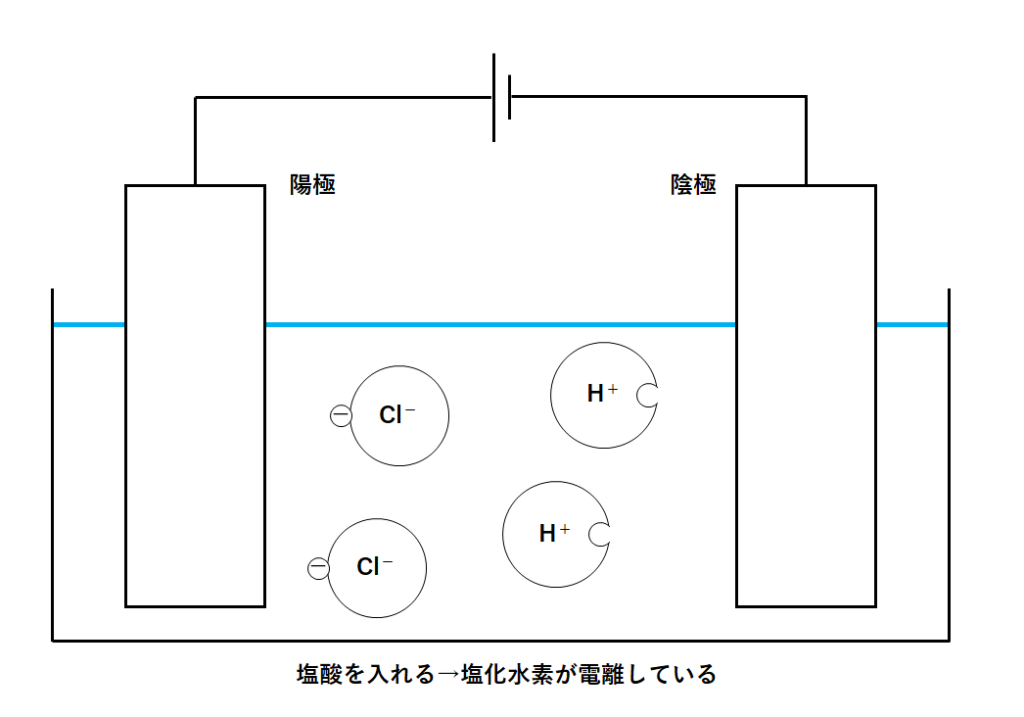
①容器に塩酸を入れる
塩酸とは水に塩化水素が溶けた水溶液です。
塩化水素は電解質なので、水素イオンと塩化物イオンに電離しています。
(↓の図のように)
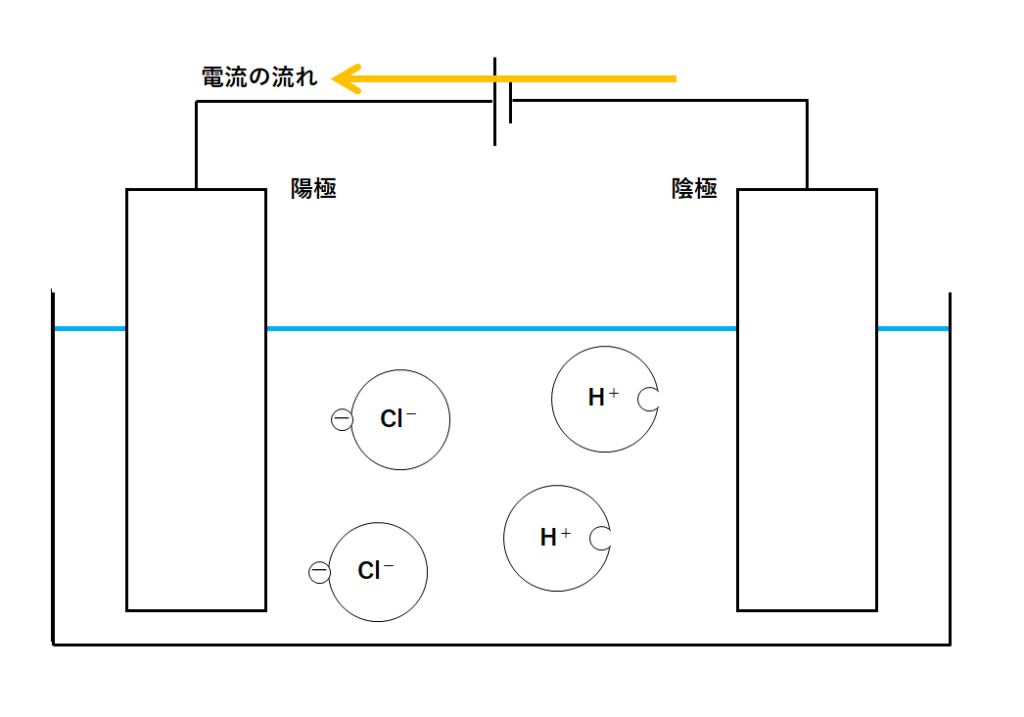
②電流が流れだす
電源装置をつなぐと電流が流れ出しますね。
下の矢印の向きに電流が流れ出します。
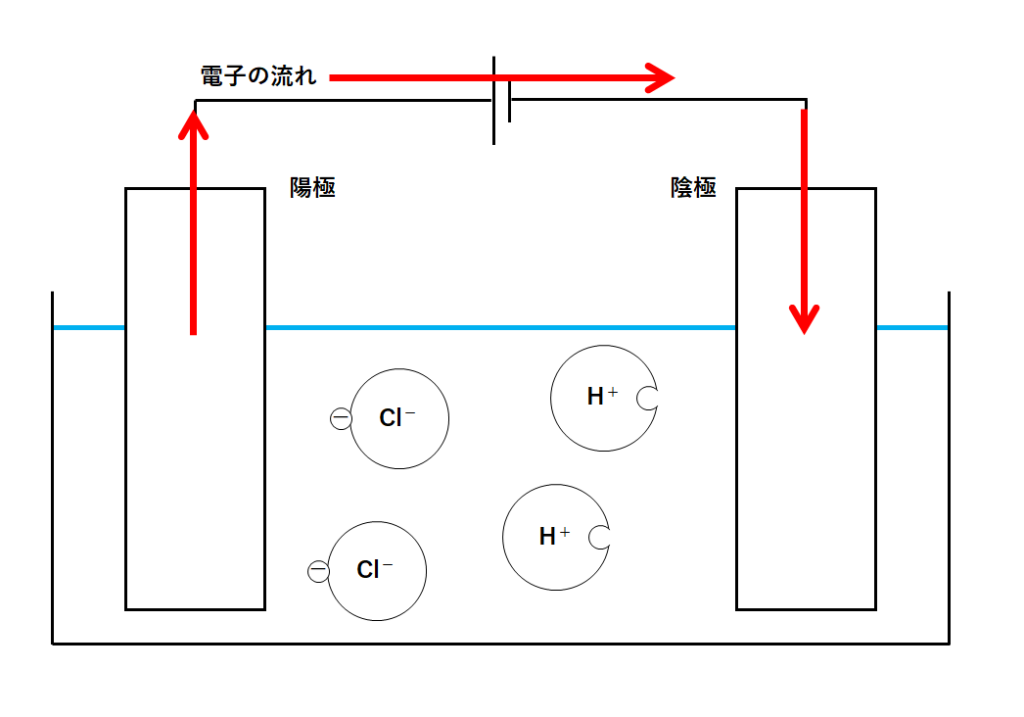
③電子の流れ
電流の正体は電子の流れです。
しかし電流の流れは電子の流れと反対向きでしたね。(↓の図)
電源装置は電子を動かす役目をします。
そのためには陽極で誰かから電子をもらう必要があります。
④陽極での変化
誰から電子をもらうのがいいでしょうか?
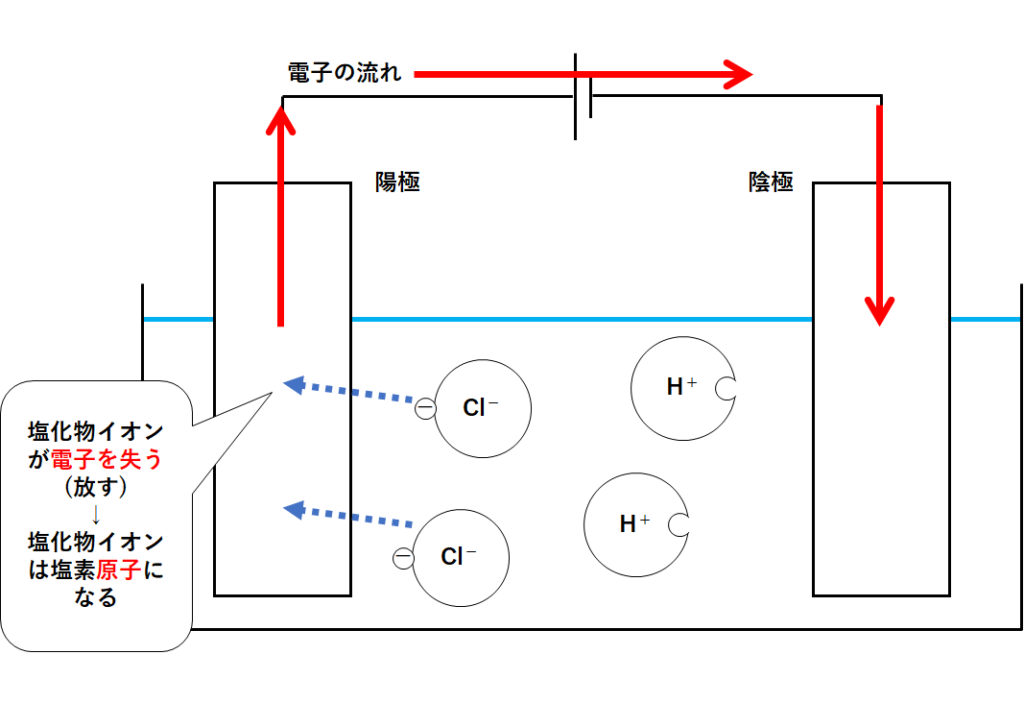
この容器の中で電子を多くもっているのは塩化物イオンCl-です。
塩化物イオンCl-は、塩素原子が電子を得てできたもの。
(よくわからない人は→【イオンとは】←を読んでみてください。)
塩化物イオンは陽極に近づき、多く持っている電子を渡します(陽極に電子を渡す)。
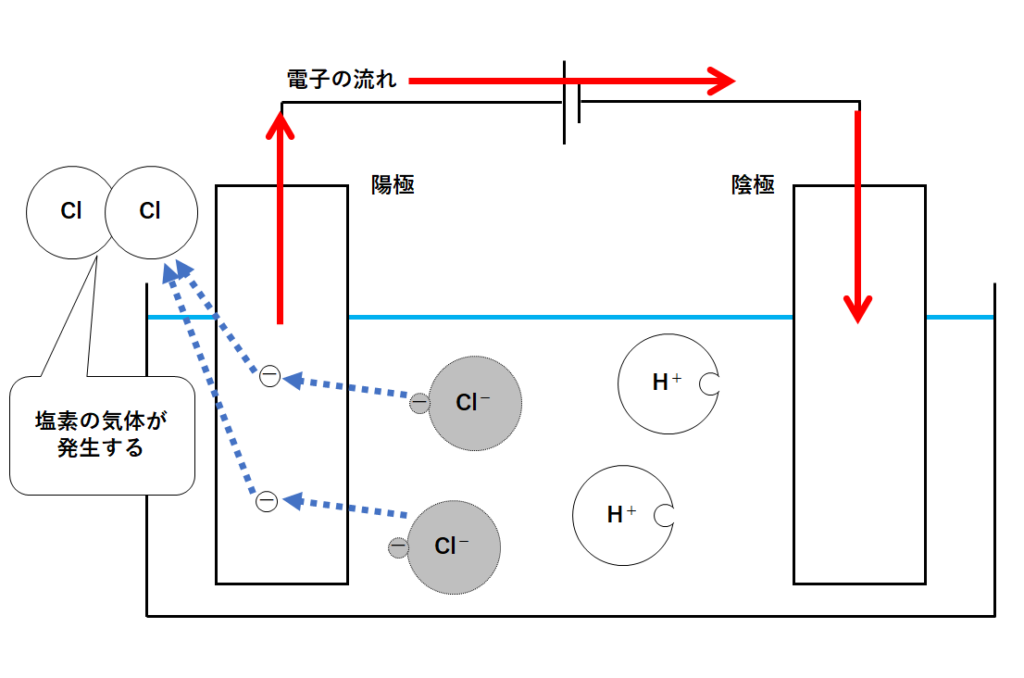
塩化物イオンは電子を失うことで塩素原子となります。(↓の図)
その塩素原子が2つ結びつくと塩素の気体Cl2となります。
このように陽極側では塩素の気体が発生するのです。(↓の図)
⑤電子の移動
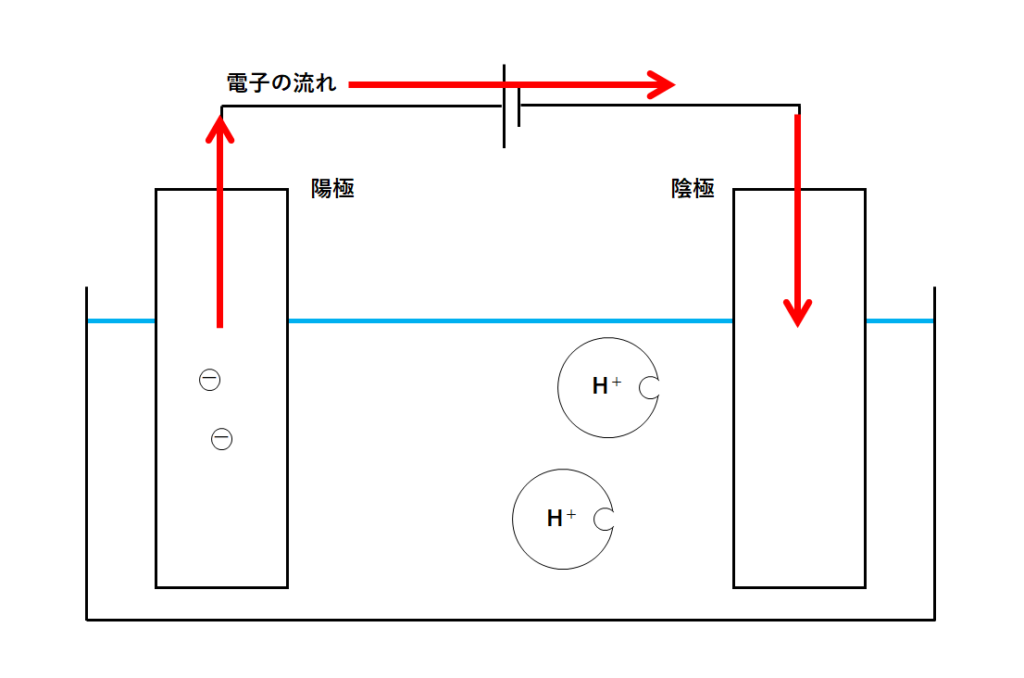
陽極には塩化物イオンが渡してくれた電子がありますね。(↓の図)
この電子は電源装置のはたらきによって陰極に運ばれます。(↓の図)
放っておくと、陰極には電子はどんどんたまっていくばかりです。
この電子を誰かに持って行ってもらう必要があります。
⑤陰極での変化
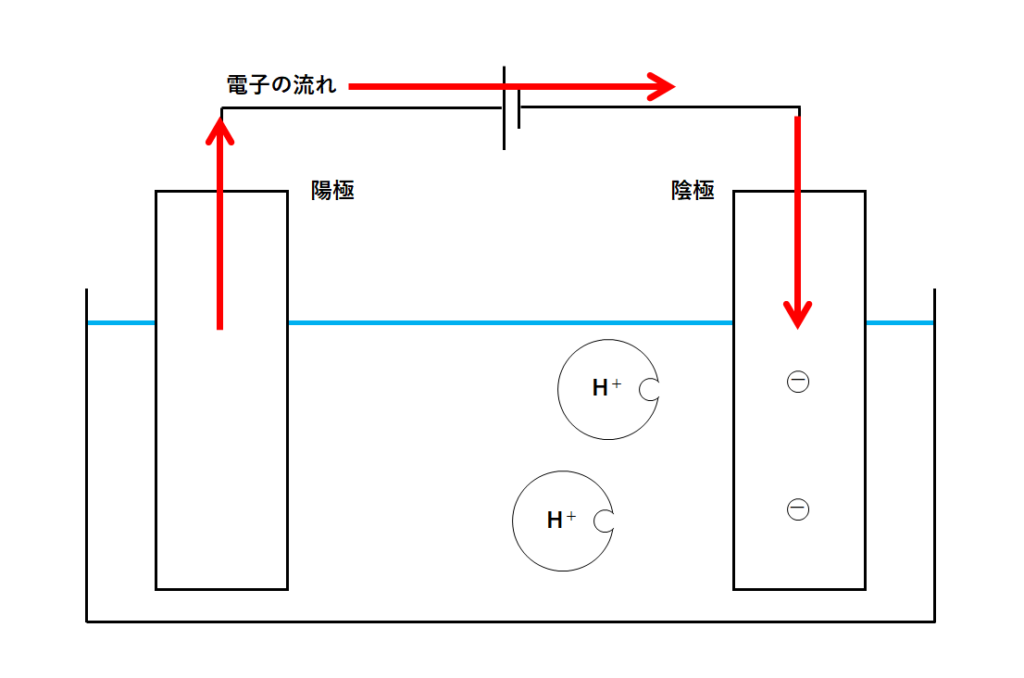
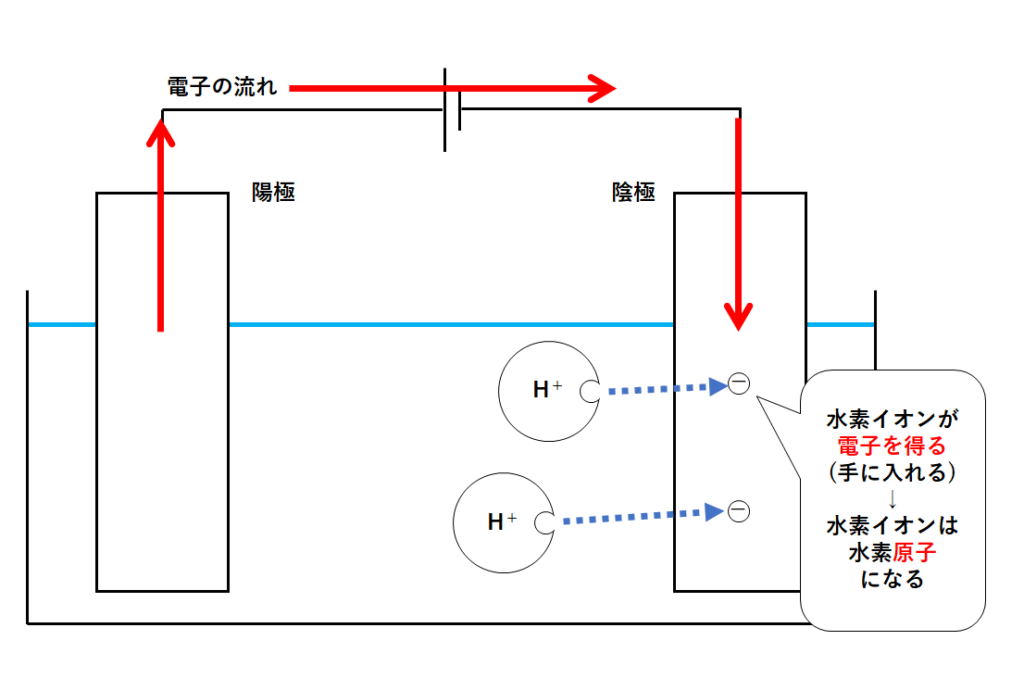
陰極にたまった電子をもらうのが水素イオンH+です。
水素イオンH+は、本来の水素原子が電子を失ってできたもの。
ちょうど電子が足りてない・・・という状態なわけです。
そこで水素イオンは陰極に近づき電子を得ます(陰極からもらう)。
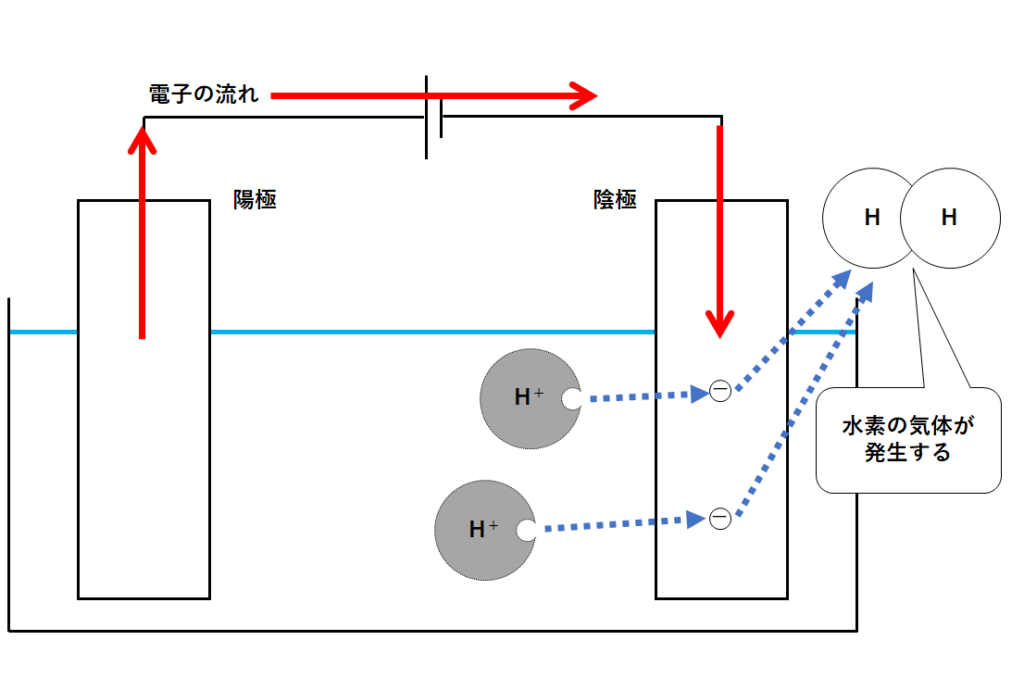
そうすることで水素イオンは電子を得て水素原子となります。(↓の図)
この水素原子が2つ結びつくと水素の気体H2となります。
このように陰極側では水素の気体が発生するのです。
⑥まとめ
【陽極で起こったこと】
・塩化物イオンが近づき電子を失った。(塩素の気体が発生)
・式で書くと 2Cl- → Cl2 + 2e-
※e–は電子のことです。
【陰極で起こったこと】
・水素イオンが近づき電子を得た。(水素の気体が発生)
・式で書くと 2H+ + 2eー → H2
【全体として】
・塩酸中の塩化水素が塩素の気体と水素の気体へと変化した。
・化学反応式で書くと 2HCl → H2 + Cl2
・液中の塩化水素(溶質)のみが減少するので塩酸の濃度は下がっていく。
このように、電源装置が無理やり電子を動かします。
それに伴って
塩化物イオンCl-は電子を失い、水素イオンH+が電子を得る
ことになります。
そして塩化物イオンは塩素原子になり、水素イオンは水素原子になります。
これが電気分解の基本原理です。
3.塩素の性質
■塩素の性質
・黄緑色の気体
・プールの消毒のようなにおいがある
・脱色作用がある・・・赤インクを近づけると色が抜ける
・水に溶ける・・・実は、電気分解の実験では塩素は集まりにくい
・空気より重い
・水に溶けると酸性


コメント(承認された場合のみ表示されます)