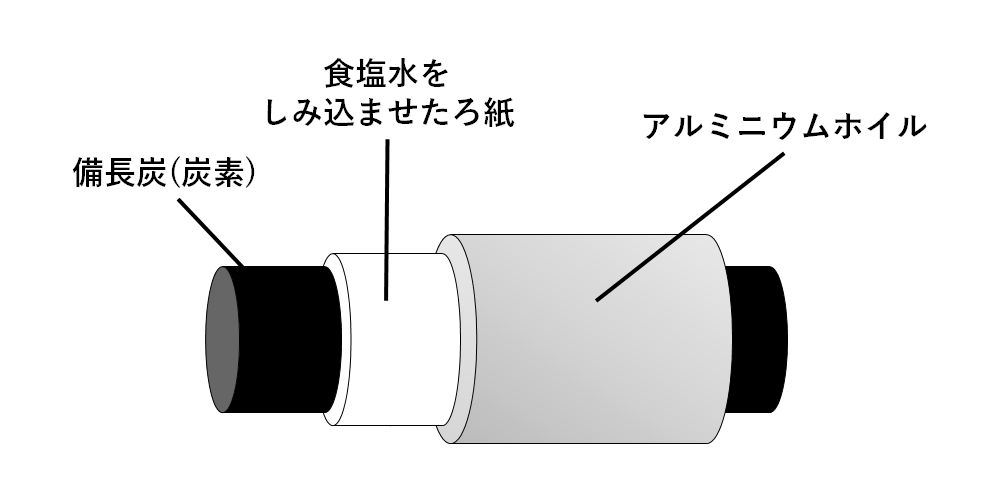
1.備長炭を使った電池
備長炭電池の仕組み
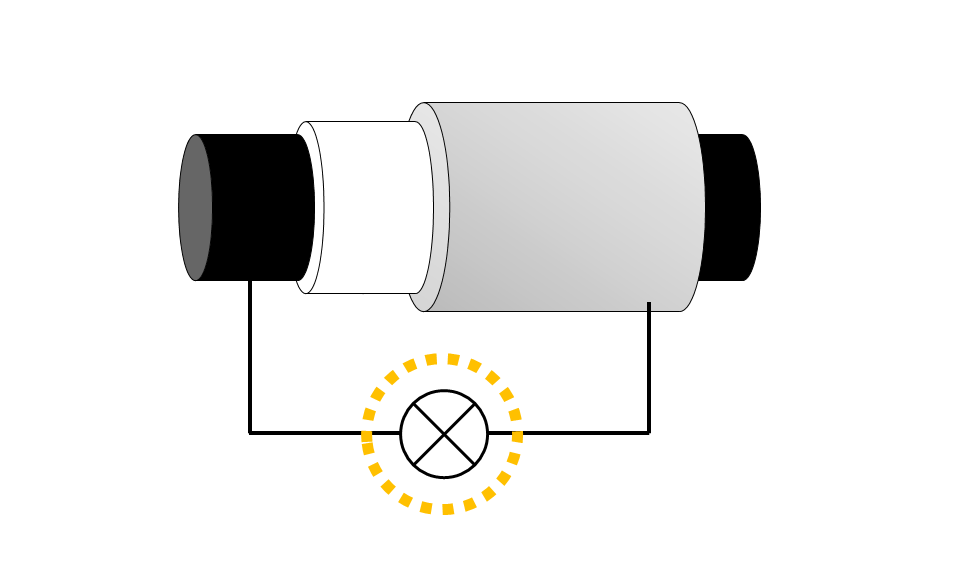
備長炭電池に↓のように電球をつなぐと電球が光ります。
ボルタ電池とは見た目は全く違いますが、この原理はボルタ電池と似ています。
(ボルタ電池のしくみは→【電池の仕組み】←を参考に)
電極としてアルミニウムと炭素を使い、電解質水溶液として食塩水を準備した電池ととらえてあげましょう。
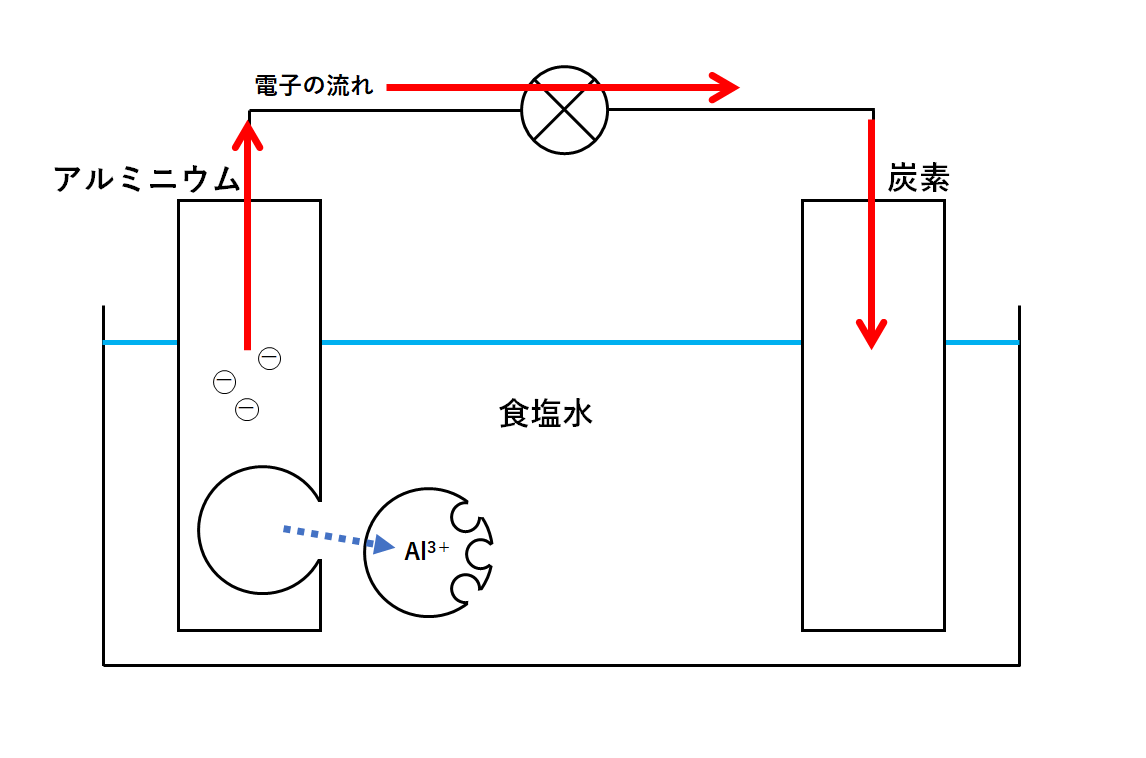
模式的に書くと、↓の図のような電池です。
ではこの原理を考えましょう。
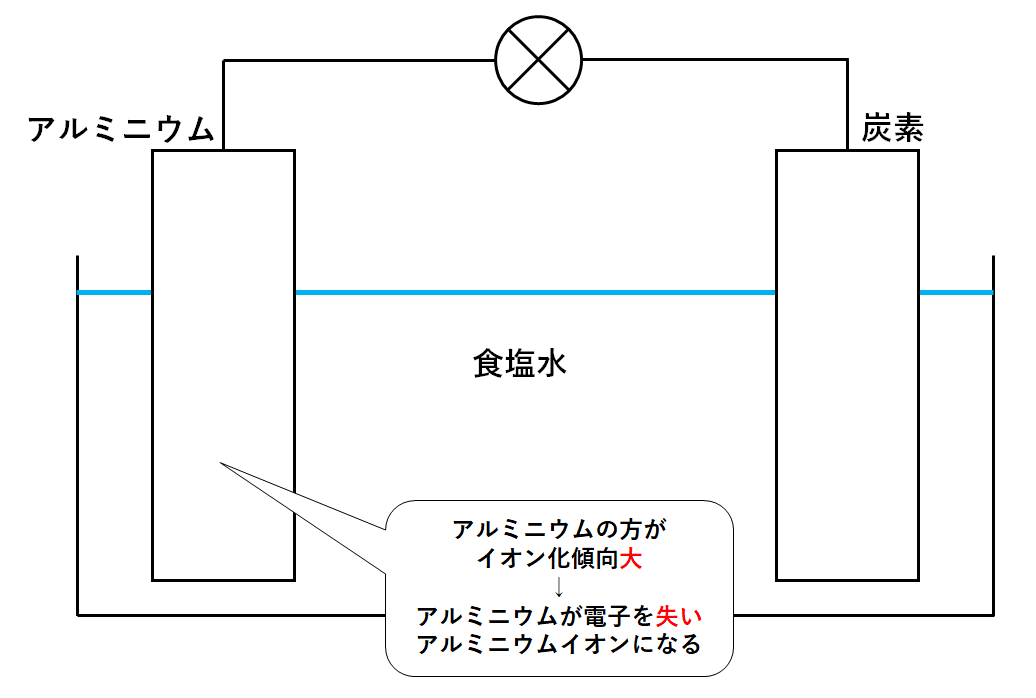
まずは、アルミニウムと炭素のイオン化傾向を考えます。
といっても炭素はイオンにはなりません。
なのでアルミニウムの方がイオン化傾向は大きい(アルミニウムの方がイオンになりやすい)です。(↓の図)
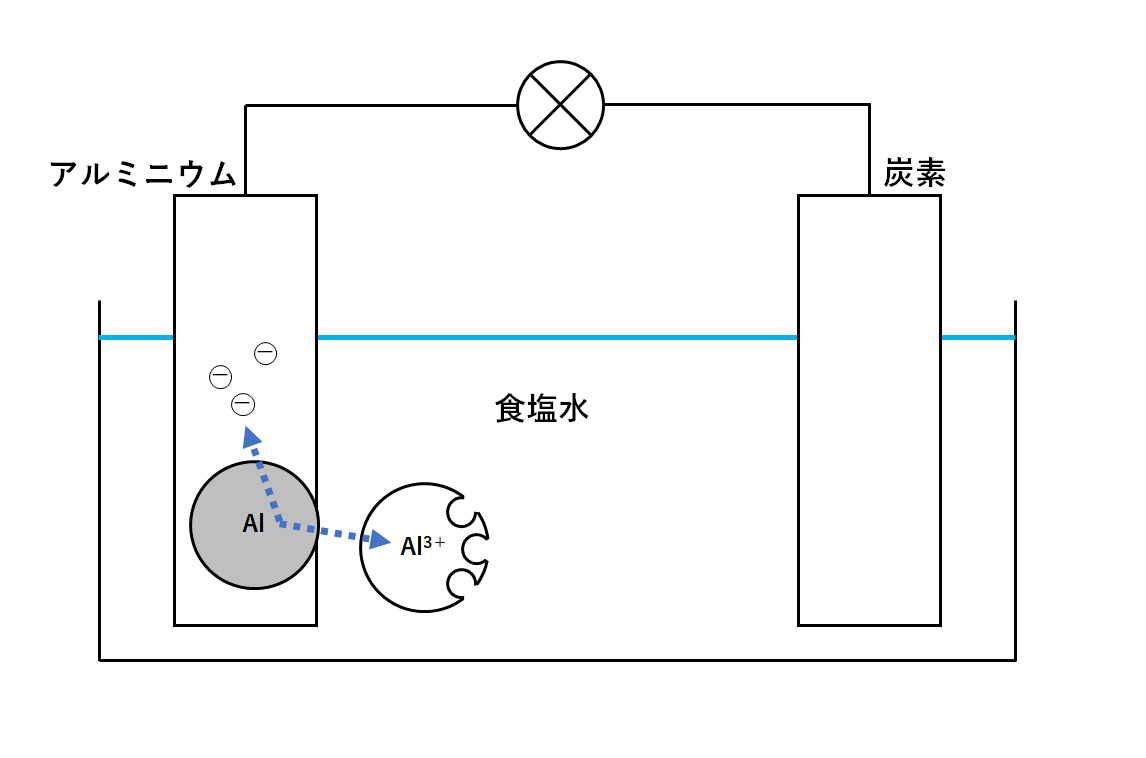
よってアルミニウム原子が電子を失いアルミニウムイオンになります。(↓の図)
式で書くと
反応の様子: Al → Al3+ + 3e–
アルミニウムイオンが食塩水に溶けだすので、見た目ではアルミホイルがぼろぼろになっていきます。
一方で、アルミニウム原子が失った電子は、導線を通って炭素の方へ移動します。(↓の図)
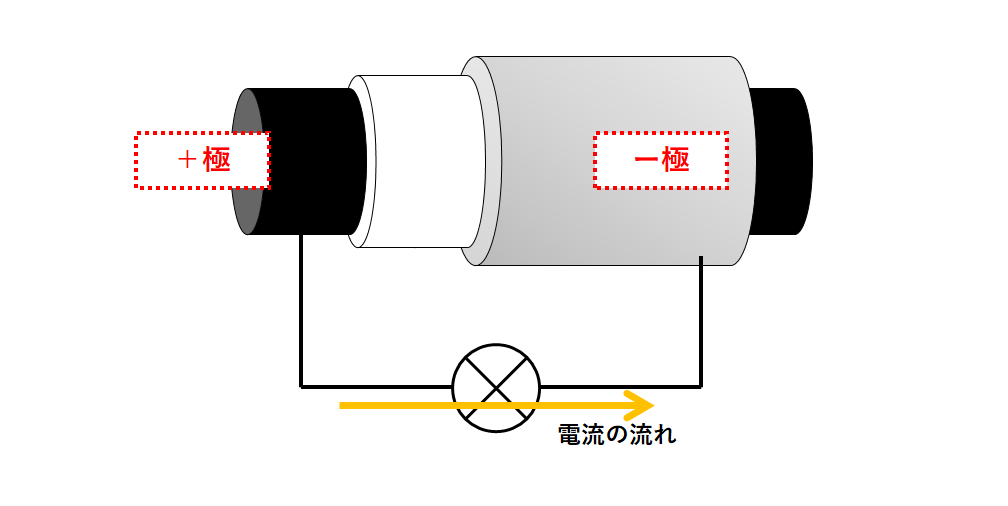
電子の流れと電流の流れは反対です。
よって
アルミニウム・・・-極(負極)
炭素・・・・・・・+極(正極)
となります。(↓の図)
もとの図で考えると↓の図の矢印の向きに電流が流れていることになります。
※備長炭側では・・・ *かなり発展
備長炭側では空気中の酸素が次のような反応を起こします。
2H2O + O2 +4e-→4OH-
これとアルミニウムイオンAl3+が反応し、水酸化物が生じます。
備長炭は酸素を引き寄せる作用(吸着作用)があり、また酸素の反応の触媒としても利用できるため、電池としてうまく成立しています。
2.燃料電池
水の電気分解は、次の式で表される化学変化です。
反応式: 2H2O → 2H2 + O2
(中2で学習済み。詳しくは→【分解】←を参考に。)
この反応では、水に電気エネルギーを与えて化学エネルギーに変換しています。
それとは反対の反応を利用して、次の化学変化を起こします。
反応式: 2H2 + O2 → 2H2O
水素や酸素のもつ化学エネルギーを電気エネルギーとして取り出しています。
このようにして電流を取り出す装置が燃料電池です。
水素と酸素をもとにした電池とも言えます。
生じる物質が水のみです。
そのため有害な物質が生じないので、環境への悪影響が少ないという利点があります。
3.その他の電池
使うと電圧が低下し、元にもどらない電池。充電できない電池。
例)
・マンガン乾電池・・・リモコンなどに利用
・アルカリ乾電池・・・リモコンなどに利用
・リチウム電池・・・・腕時計などに利用
・空気電池・・・・・・補聴器などに利用
充電ができる電池。蓄電池ともいう。
例)
・鉛蓄電池・・・・・・・・車のバッテリー
・ニッケル水素電池・・・・デジカメ
・リチウムイオン電池・・・携帯電話・携帯ゲーム機
POINT!!
・備長炭電池では「炭素が+極」「アルミニウムが-極」である。
・燃料電池は、水の電気分解と逆の反応を利用。環境にやさしい。
・一次電池と二次電池の違いを覚える。例までは無理して覚えなくてもいい。



コメント(承認された場合のみ表示されます)
リチウム電池は一次電池ですが、イオンがついてリチウムイオン電池になると二次電池になるわけですね。イオンが電池を充電可能なものにしてくれるというわけですね。でも、なぜそうなるのかが不思議です。
匿名希望様
コメントありがとうございます。
リチウム電池は極に金属であるリチウムが使われており、リチウムイオン電池は極にリチウムイオンからなる化合物が使われているようです。
そのため原理が全く異なるものとして区別するために、のちに開発された方をリチウムイオン電池という名称になったようです。
そうなのですね。 わかりやすく教えてくださってありがとうございました。
匿名希望様
こちらこそありがとうございました。
また何かございましたらいつでもご覧ください。
なぜ、電池を作るときに備長炭を用いるのですか?アルミニウムよりもイオン化傾向が小さいものであれば何でもよいのではないかと考えました。
たいせい様
コメントありがとうございます。
備長炭を使う理由は手に入りやすく安価であるということが大きいと思います。
もちろんアルミニウムよりもイオン化傾向が小さいものであれば、それで電池をつくることは可能です。
化学エネルギーとはなんですか?また、電気エネルギーとはなんですか?
nakaharu様
エネルギーとは、別の物体を動かしたり変形させたりする能力のことです。
そのうち、化学エネルギーはもともと物質が持っているエネルギーです。
電気エネルギーは電気が持つエネルギーです。