このページでは「化学電池やボルタ電池のしくみ」「イオン化傾向とは?」について解説しています。
動画による解説は↓↓↓
チャンネル登録はこちらをクリック↓↓↓
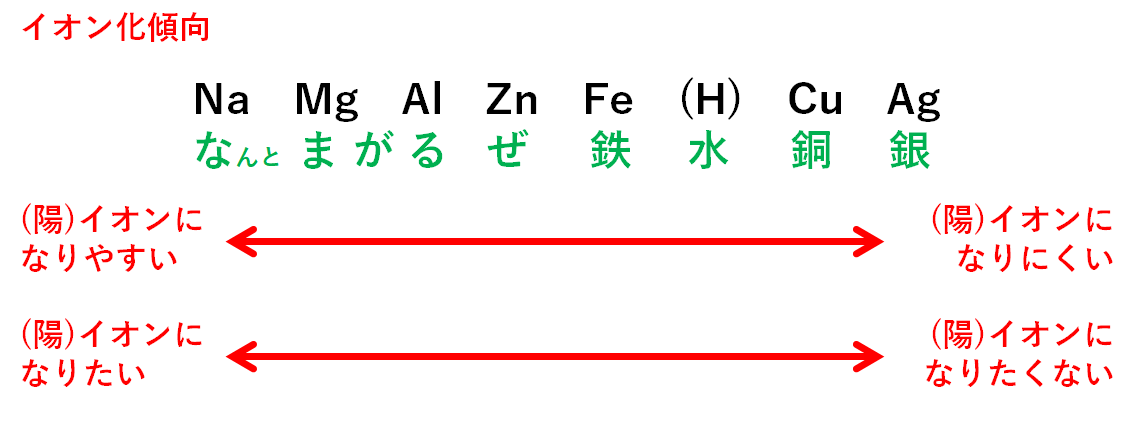
1.イオン化傾向
どの金属がどれだけ(陽)イオンになりやすいかという順番。
※金属は陰イオンにはなりません。すべて陽イオンになります。
↓の金属についてイオン化傾向を覚えておきましょう。(※水素は金属ではないですが覚えておいてください。)
左にあるものほど(陽)イオンになりやすく、電子を失いやすい。
右にあるものほど(陽)イオンになりにくく、電子を失いにくい。
(金属は陰イオンにはなりません)
言い換えると
左にあるもの・・・イオンになりたい、イオンのままでいたい。
右にあるもの・・・イオンになりたくない、原子のままでいたい。
※ですので左にある金属ほど他の物質と反応しやすいということでもあります。
2.電池とその仕組み
化学変化によって電流を取り出す装置。
物質の持つ化学エネルギーを電気エネルギーに変えている。
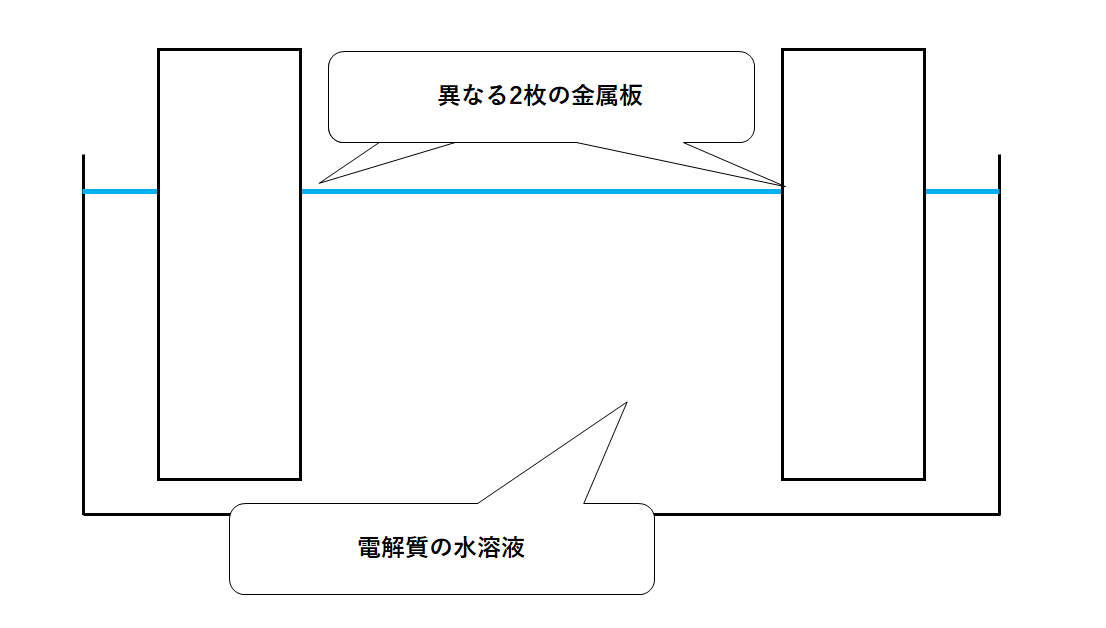
電池をつくるために必要なもの
①電解質水溶液が必要
塩酸や硫酸、食塩水、柑橘系の果物(レモン・オレンジなど)などの電気を通す水溶液です。
砂糖水・エタノールは非電解質の水溶液なのでダメです。
②異なる2枚の金属板が必要
電池の+極、-極になるための金属板です。
イオン化傾向の異なる金属である必要があります。
※同じ金属では電気を取り出せない。
電池のしくみ
電解質水溶液と2枚の異なる金属板を↓の図のようにセットしましょう。
これで電池の完成です。すごく単純な構造です。
ここに導線で豆電球をつないでやると豆電球は光ります。
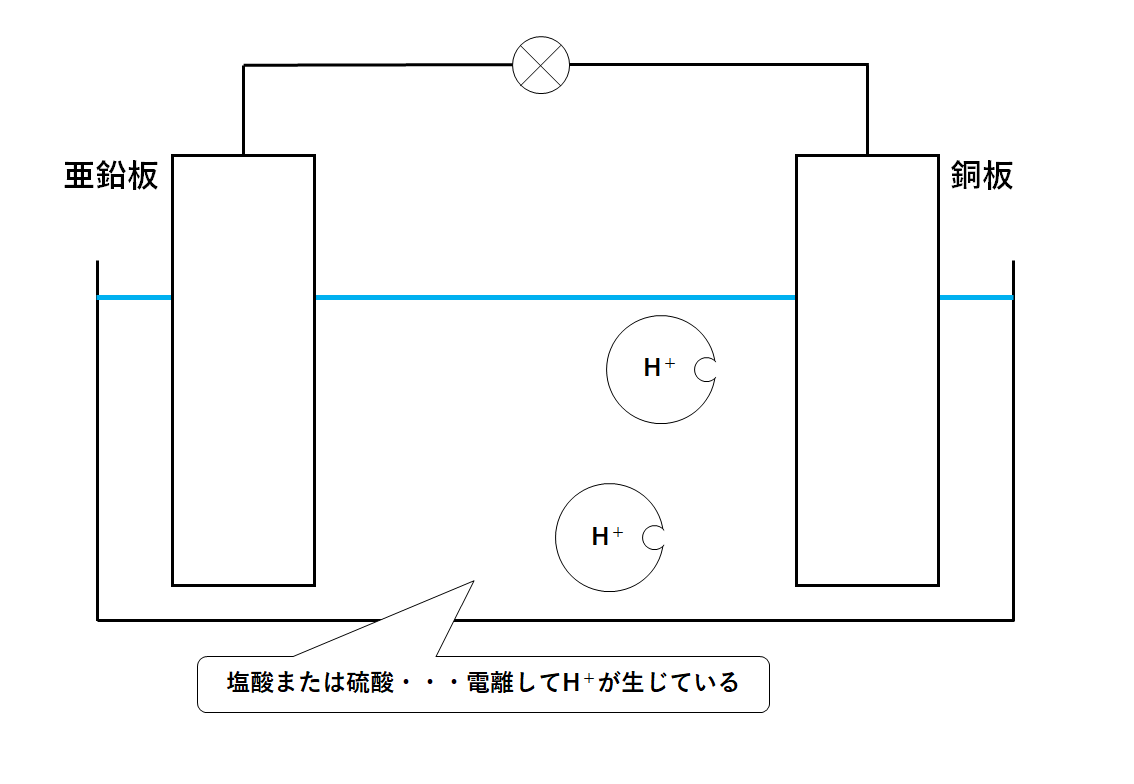
はじめにこの電池をつくったのはボルタという学者さんです。
ボルタさんは
・電解質水溶液に硫酸(または塩酸)
・異なる2枚の金属板に亜鉛と銅
を使用して電池をつくりました。(↓の図)
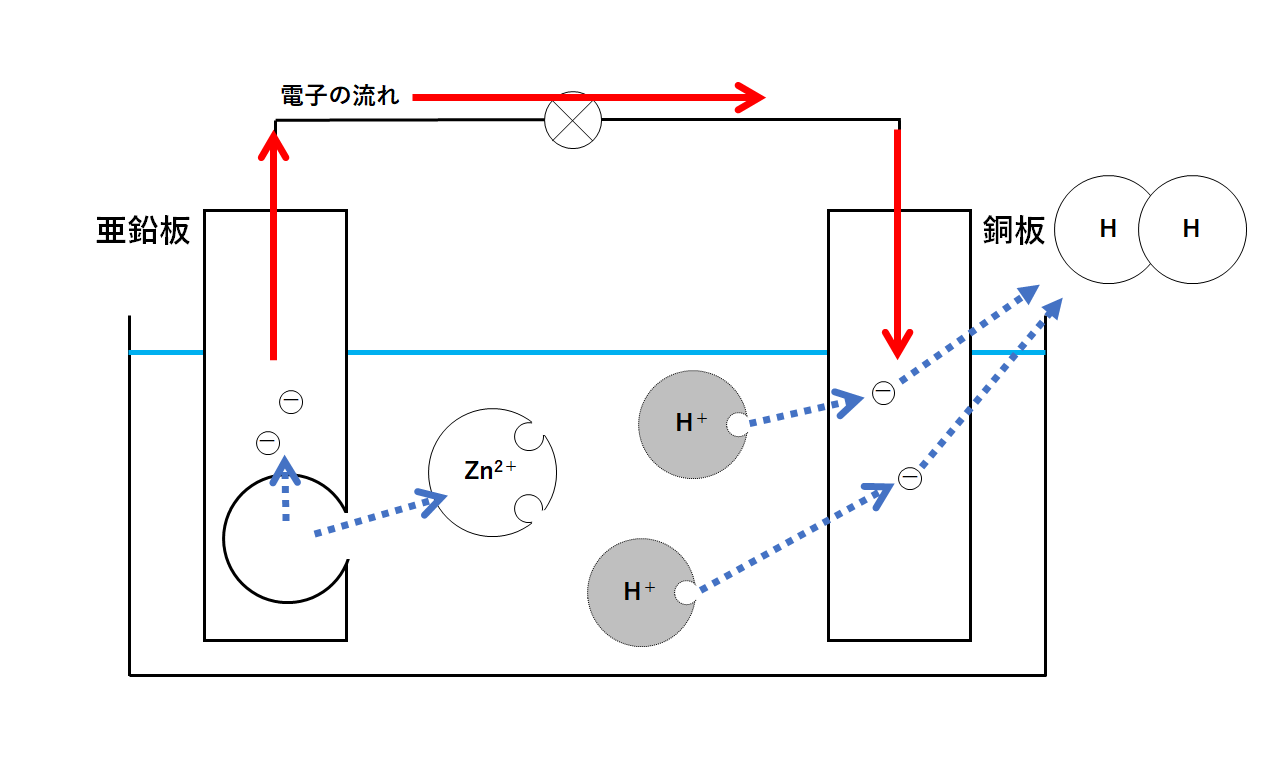
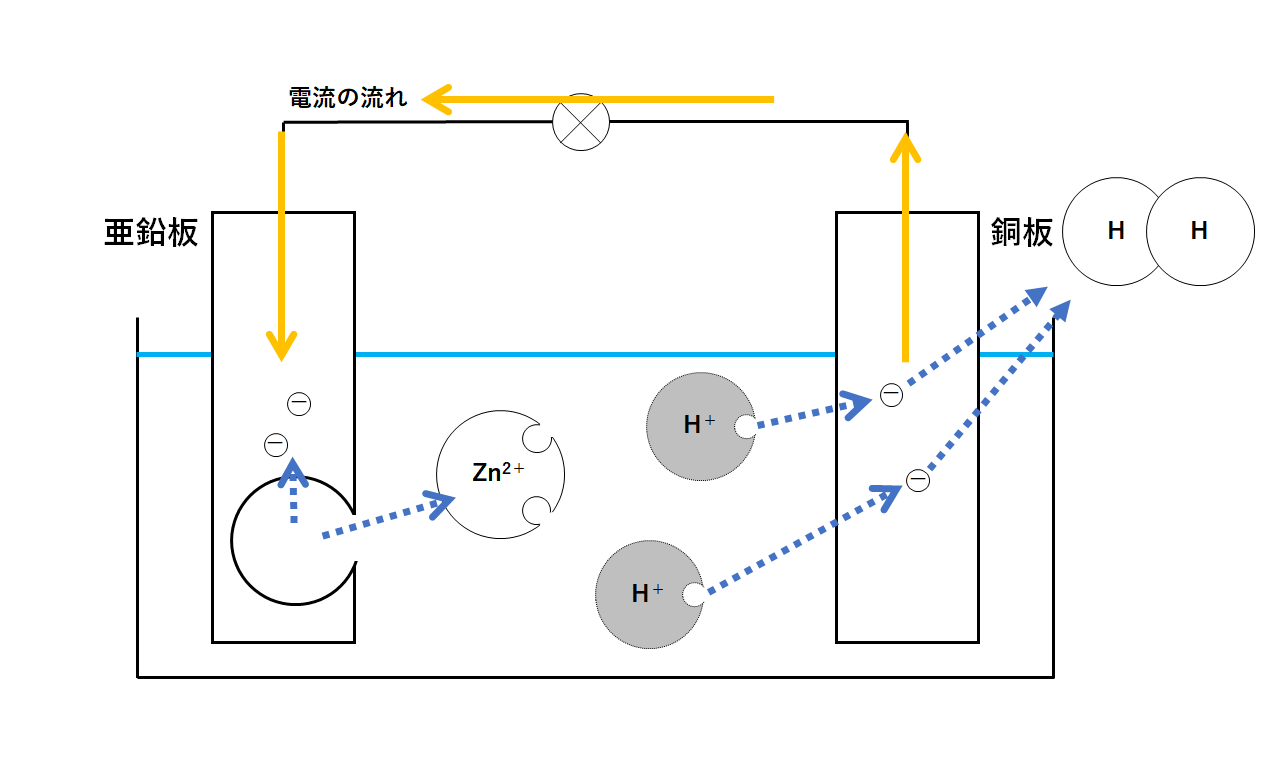
ここからどのようにして電流が取り出せるか見てみましょう。
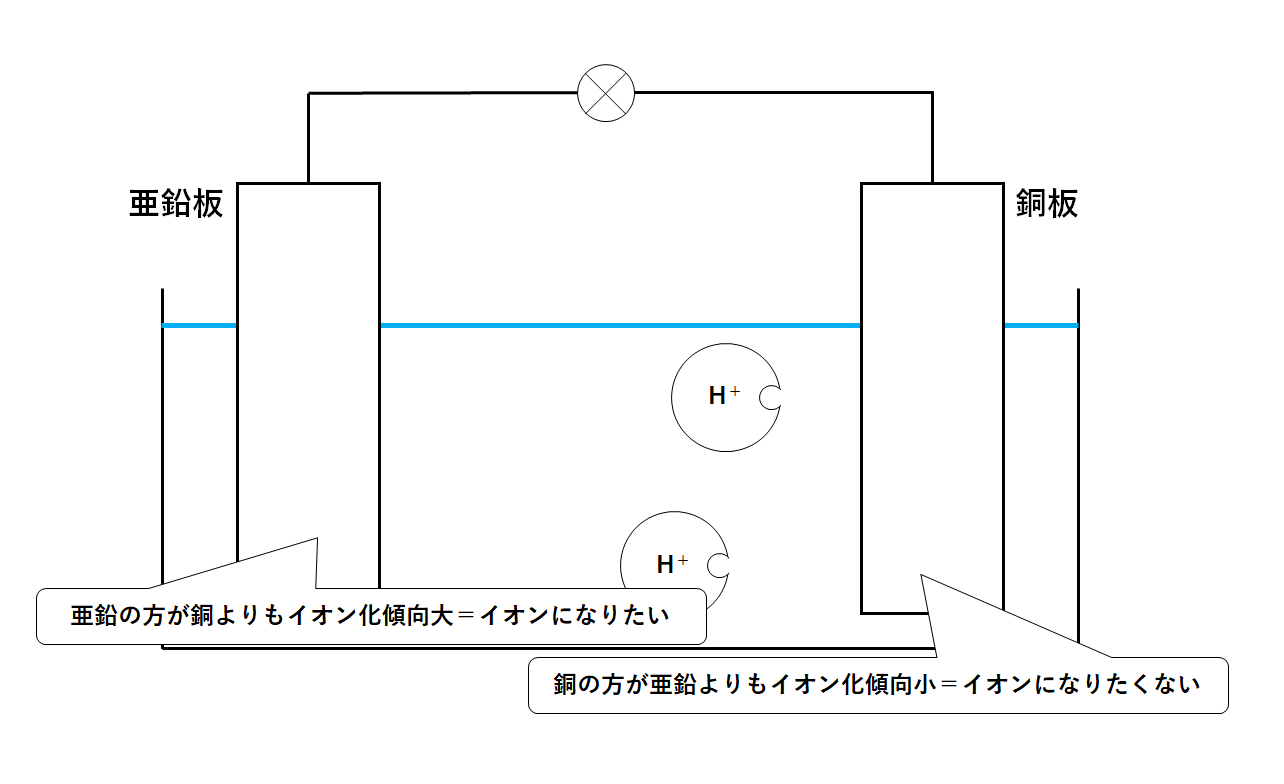
亜鉛板と銅板が導線でつながっています。
亜鉛と銅のイオン化傾向のちがいを考えます。
イオン化傾向を比べると亜鉛板の方が大きい。
つまり
亜鉛板・・・(陽)イオンになりたい
銅板・・・・(陽)イオンにはなりたくない
という差が生じているのです。(↓の図)
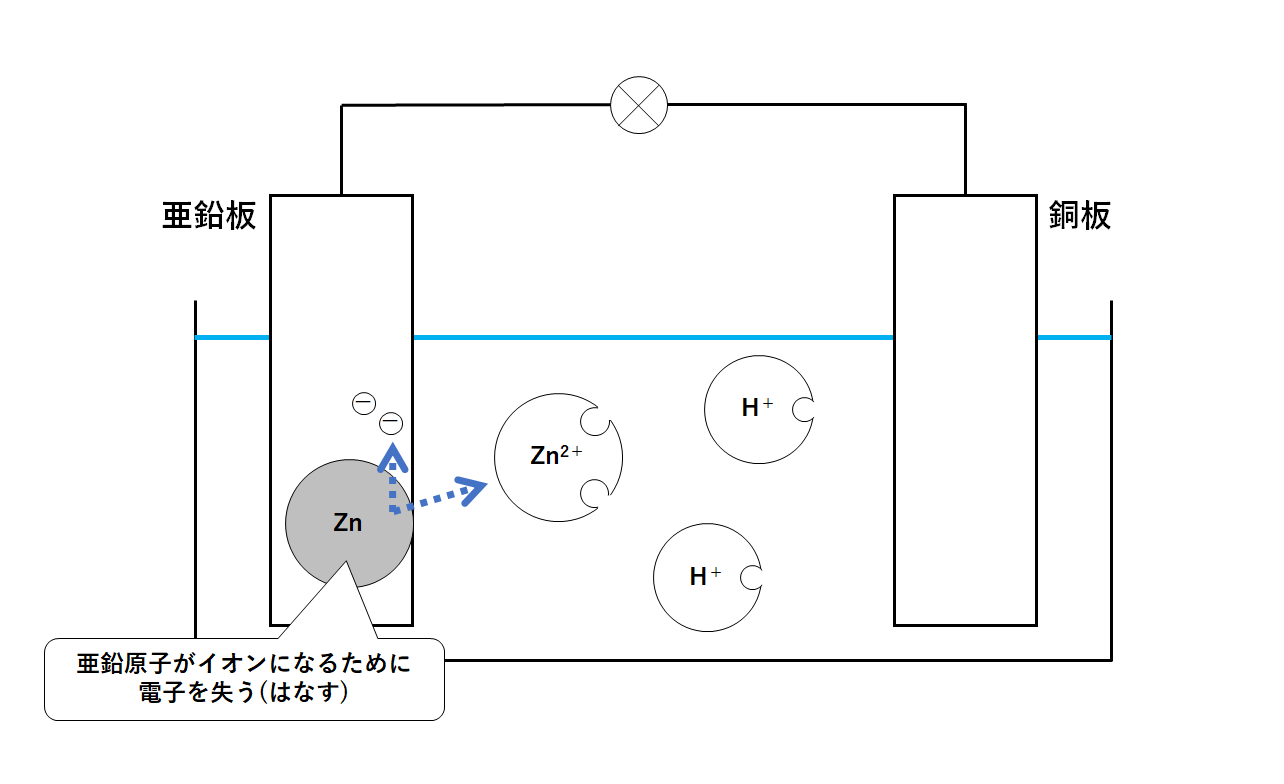
そこで亜鉛板の中の亜鉛原子Znが亜鉛イオンZn2+になろうとします。
そのため亜鉛原子Znが電子を失って、亜鉛イオンZn2+になります。(↓の図)
式で書くと
Zn → Zn2+ + 2e– ※e–は電子のこと。
このように亜鉛板の亜鉛原子は亜鉛イオンへと変化して液中に移動します。
観察していると、亜鉛板がどんどん液中に溶けだし、ぼろぼろになっていきます。
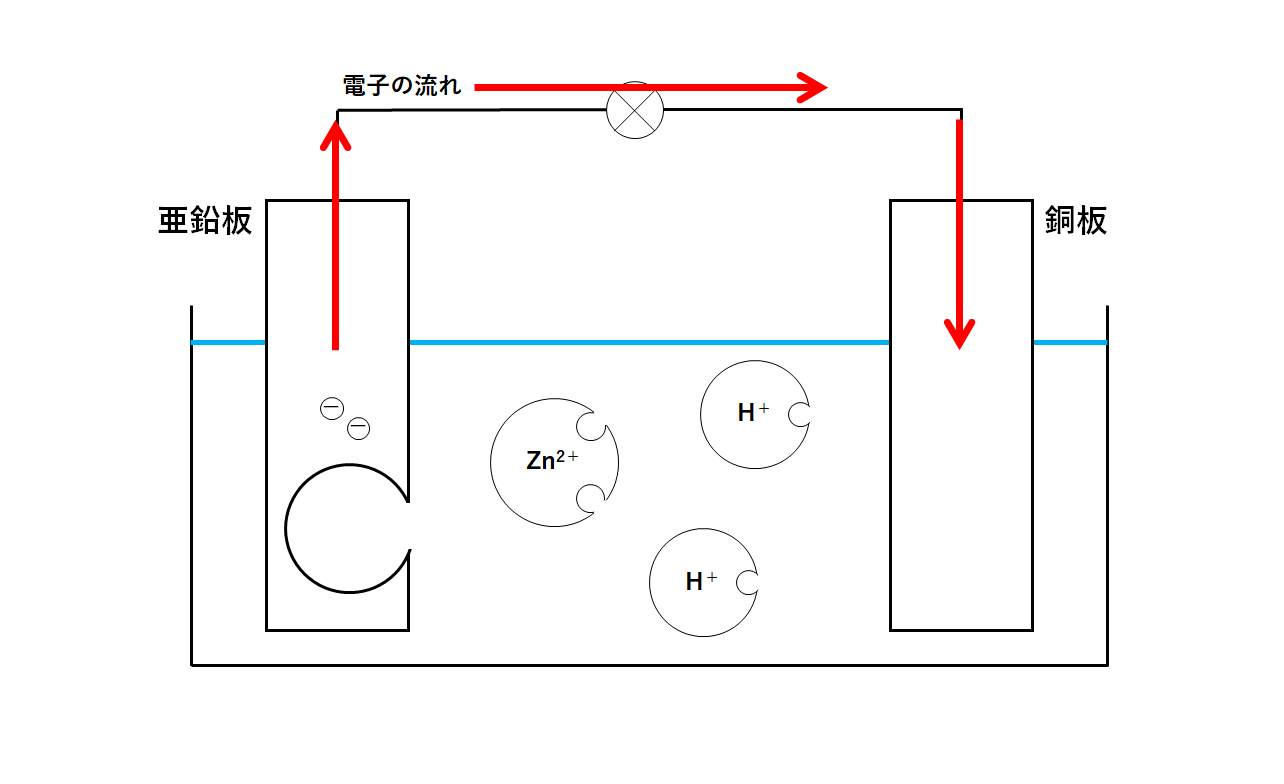
亜鉛原子が失った電子は導線を通って銅板に移動します。(↓の図)
銅板にはどんどん電子がたまります。
そのため、だれかに電子を持っていってもらわなければなりません。
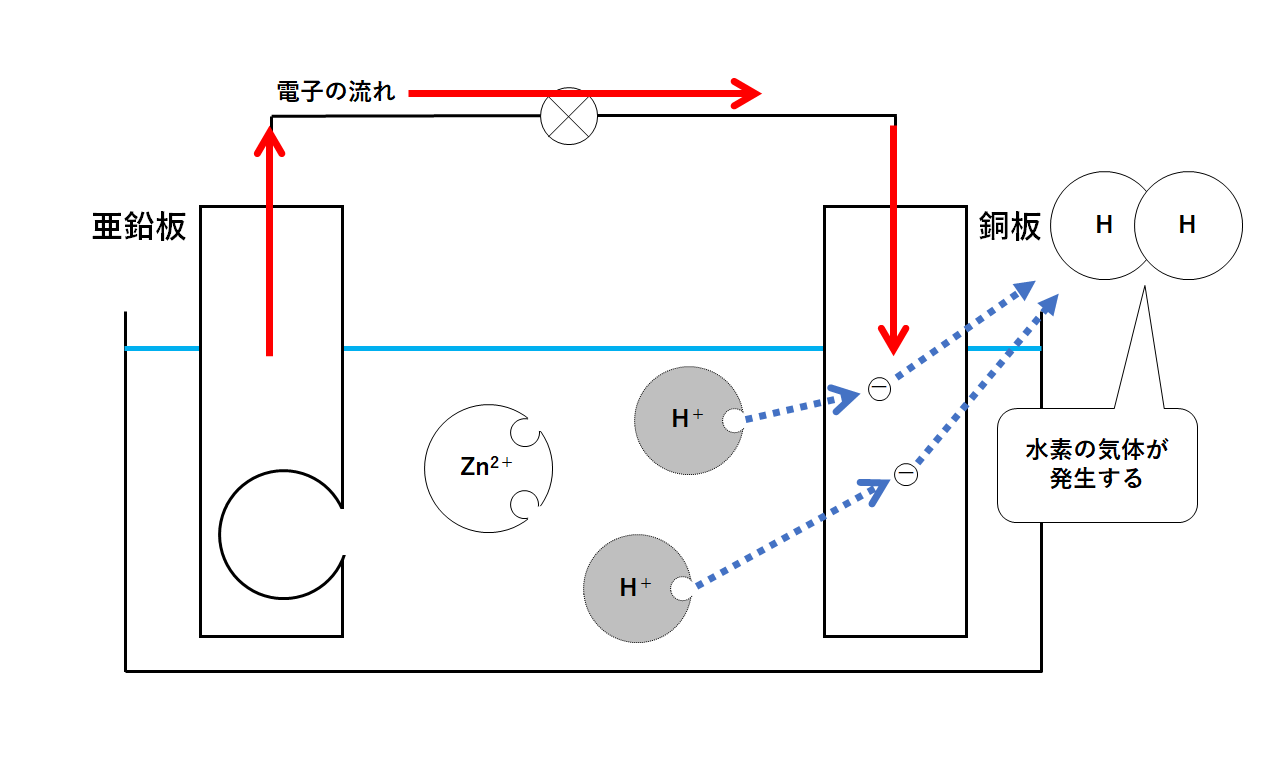
そこで水素イオンH+の出番です。
先ほどのイオン化傾向を見ると水素は右の方にあります。(↓右から3番目)
つまり水素イオンは、イオンのままではいたくない=原子にもどりたいのです。
よって水素イオンは、銅板にたまった電子を得て水素原子へと戻ります。(↓の図)
式で書くと
2H+ + 2e– → H2 ※e–は電子のこと。
よって銅板からは水素の気体が発生します。(↓の図)
実際には、水素の泡が銅板にたくさん付着します。
ボルタ電池のしくみのまとめ
これまでの説明をもう一度図にまとめます。(↓の図)
・亜鉛板・・・亜鉛原子が電子を失う。亜鉛板はぼろぼろに。
・銅板・・・・水素原子が電子を得る。水素の気体発生。
ここで、中2の電流回路の単元で
電子の流れと電流の向きは反対
と学習したことを思い出して下さい。
この装置に流れる電流は↓のようになります。
つまり
亜鉛板 → -極(負極)
銅板 → +極(正極)
となっているのです。
ボルタ電池で覚えておきたいこと
銅板の表面が水素の泡でおおわれてしまうと銅板で電子の受け渡しができなくなる。
つまり電流が流れなくなる。
このように気体が電極をおおって電子の受け渡しをさまたげることを分極という。
分極を防ぐためには過酸化水素水が用いられる。
ボルタ電池には明確な弱点があります。
それがこの分極作用です。
この分極作用が起こらないように改良した装置にダニエル電池があります。
ダニエル電池については→【ダニエル電池】←を参考に。
3.イオン化傾向と電池
電池から取り出せる電圧のこと。
■起電力を大きくするには
イオン化傾向の差が大きい金属を組み合わせる。
「鉄と亜鉛の組み合わせ」より「マグネシウムと鉄の組み合わせ」の方が起電力は大。
イオン化傾向が大きい方の金属 → その金属が電子を失い、陽イオンになる。-極になる。
イオン化傾向が小さい方の金属 → 液中の陽イオンが電子を得る。+極になる。




コメント(承認された場合のみ表示されます)
神
さすまた様
コメントありがとうございます。
理解してもらえたなら何よりです。
god
平民様
コメントありがとうございます。
理解してもらえたようなら幸いです。
またよければご覧ください。
電解液において酸性の強さは電力を変化させますか?
シャル様
コメントありがとうございます。
電池の起電力は電極となる金属のイオン化傾向の差によって決まります。
酸性の強さは関係ありません。
[…] →【電池のしくみ】← […]
水の電気分解では、水素イオンはプラスの電気を帯びているため、+極に引きつけられてで水素が発生すると理解しています。
電池の場合、銅板(+極)から水素が発生しますが、なぜ水素イオンは亜鉛版(-極)に引きつけられ、そこから電子をうけとり陰極で水素が発生しないのでしょうか?
すみません、先ほどのコメントの訂正です。
(水の電気分解 → -極から水素が発生)
水の電気分解では、水素イオンはプラスの電気を帯びているため、-極に引きつけられてで水素が発生すると理解しています。
電池の場合、銅板(+極)から水素が発生しますが、なぜ水素イオンは亜鉛版(-極)に引きつけられ、そこから電子をうけとり陰極で水素が発生しないのでしょうか?
kazu様
コメントありがとうございます。
調べたところ、実際の実験では水素イオンが亜鉛板側に引き寄せられて水素の気体として発生するようです。
亜鉛板側でも 2H+ + 2e- →H2 の反応が起こるということですね。
とてもわかり易かったです。ちょうど分からなかったのでとても助かりました!
science様
コメントありがとうございます。
お役に立てて幸いです。機会があればまたご覧ください。
授業で全く理解できなくて挫けそうになっていたのでとても助かりました。ありがとうございます!
N様
コメントありがとうございます。
お役に立てて幸いです。
勉強がんばってくださいね。
亜鉛板のまわりに亜鉛イオンがあるのに、なぜ,亜鉛板は溶けだすのですか。2つの電解質水溶液がすぐに混ざらないように、セロハンで隔てられているので,この場合、銅と亜鉛のイオン化傾向で比べるのは間違えではないのですか。
AKIYAMA様
コメントありがとうございます。
銅板と亜鉛板は導線によってつながっています。(この間を電子が通ることになる)
銅板+導線+亜鉛板で1つの物体としてみてみます。
銅と亜鉛はイオン化傾向が違いますので、銅板の方は電子を得ようと、亜鉛板は電子を離そうとします。
そして電子は亜鉛板から銅板へ行きます。
その結果として亜鉛イオンが生じます。
亜鉛板のまわりに亜鉛イオンがあるかどうか、ではなく、導線でつながった金属で見てください。
わかりました。ありがとうございます。1つ疑問に思うのですが,電池はふつうスイッチを入れない状態で電子がたまって,電圧が生じるはずなので,ダニエル電池はスイッチを入れない場合は電圧が生じていないということですか。イオン化傾向がちがう異なる金属を導線でつなぐだけ,電解質溶液にいれなくても,電子の移動が起こるのですか。すいません,イオン化傾向のことを理解していないかもしれないのですこし詳しく教えてくださいませんか。
AKIYAMA様
コメントありがとうございます。
イオン化傾向の異なる2枚の金属を接触させると、「酸化還元反応」という高校で習う反応が起こります。
この反応ではイオン化傾向の大きい金属からイオン化傾向の小さい金属へと電子が移動します。
ここで電子の移動量に関しては、用いる電極の組み合わせによって変わります。
スイッチを切っている状態ですと、このような電子の移動は起こりません。
スイッチを入れることで、電子の移動が始まります。スイッチを入れて初めて電圧が生じます。
このときイオン化傾向の大きな金属は陽イオンへ変化しますが、イオンは液体中にしか基本的には存在できません。
またイオン化傾向の小さな金属には電子がたまりますが、これを受け取るイオンが必要です。
このような陽イオンが存在するための場所として、また+極に来た電子を受け取るため、電解質の水溶液が必要になります。
イオン化傾向がちがう異なる金属を導線でつなぐだけでは、わずかな電子の移動が起こるだけで終わってしまうと思われます。
ご回答ありがとうございました。スイッチを入れると直ちに電圧が生じ,水溶液中で電子をやり取りすることで電流が流れるのですね。
銅板にだんだん電子が溜まってきて、誰かに預けたい、というところまでは分かるのですが、その預けるイオンは水素イオンではなく銅イオンではダメなのですか?
分からないので教えていただきたいです!
lL様
コメントありがとうございます。
返信が遅くなり申し訳ありません。
このページで解説している電池は、電解質水溶液に硫酸や塩酸などを使っています。
つまり電離しても銅イオンが発生しません。
そのため銅イオンが電子を受け取ることはありません。