このページでは「硫酸と水酸化バリウム水溶液の中和反応」を中心に、沈殿が生じる場合の中和反応について紹介しています。
「塩酸と水酸化ナトリウム水溶液の中和反応」については→【中和反応】←を参考に。
1.中和反応
酸とアルカリが反応して互いの性質を打ち消し合う反応。
酸とアルカリが反応して水が生じる反応ともいえる。
酸・アルカリとは…
・酸・・・電離してH+を生じる物質
・アルカリ・・・電離してOH-を生じる物質
という物質でした。
※→【酸とアルカリ】←を参考に。
酸とアルカリを混ぜ合わせると、H+とOH-が結びついて水H2Oが生じます。
式で書くと
H++ OH-→ H2O
です。
この反応を中和(中和反応)といいます。
また水以外に生じる物質を塩(えん)といいます。
※詳しくは→【中和反応】←を参考に。
2.硫酸と水酸化バリウム水溶液の中和
硫酸H2SO4 は、強い酸性を示す酸です。
水酸化バリウム水溶液Ba(OH)2 は、強いアルカリ性を示すアルカリです。
この2種類を混ぜ合わせると中和反応が起こります。
硫酸と水酸化バリウム水溶液が中和反応をすると・・・
水ができます。
水以外には、硫酸バリウムBaSO4という塩ができます。
硫酸バリウムは水に溶けずに沈殿するという性質があります。
では次の実験で、硫酸と水酸化バリウム水溶液の中和について見てみましょう。
実験
②このビーカーにBTB溶液を2、3滴加える。
→ このときビーカーには硫酸が入っているのでBTB溶液は黄色に変化。
③このビーカーに水酸化バリウム水溶液を少しずつ加え、BTB溶液の色の変化を確認する。
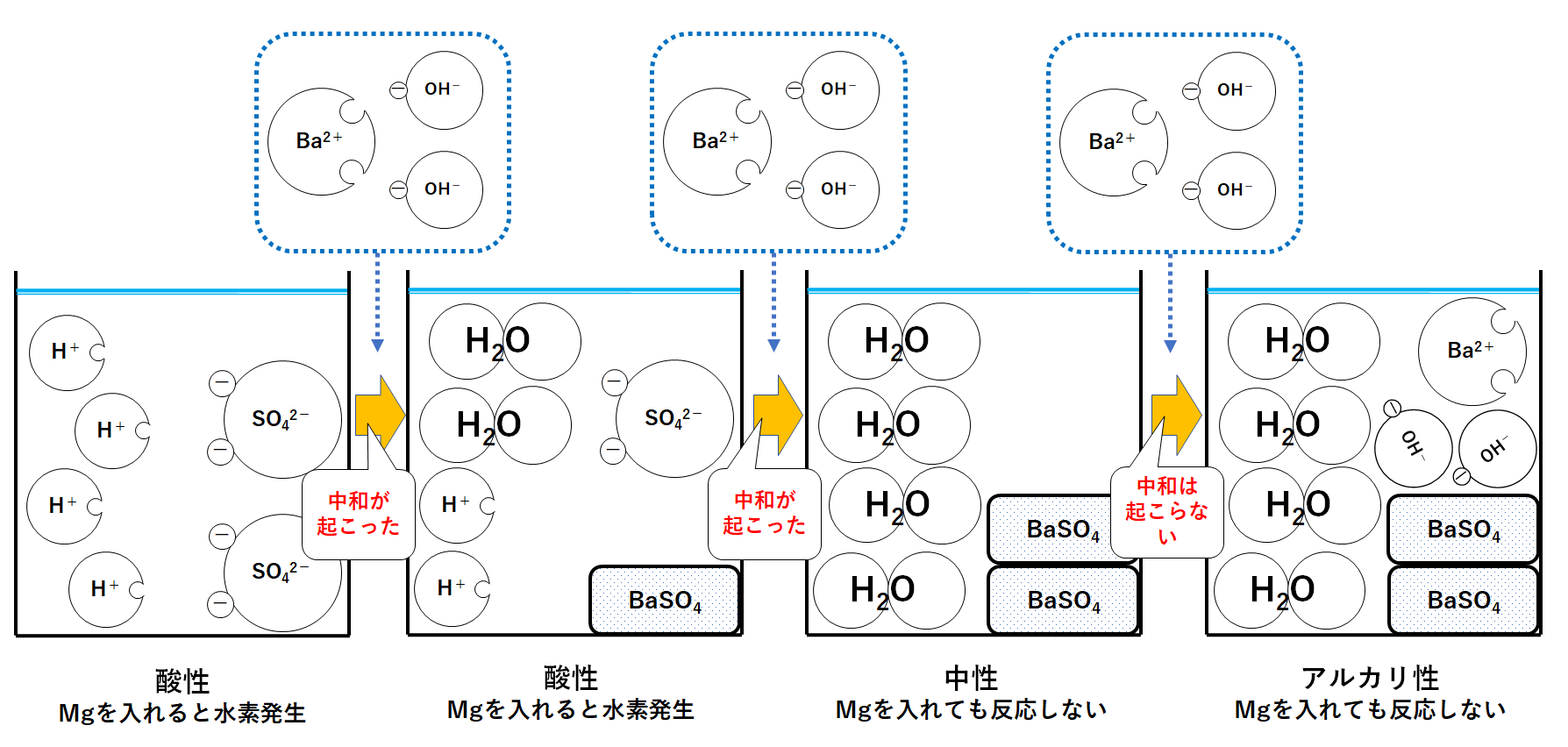
このときのビーカー内で起こっている変化を1つずつ見ていきましょう。
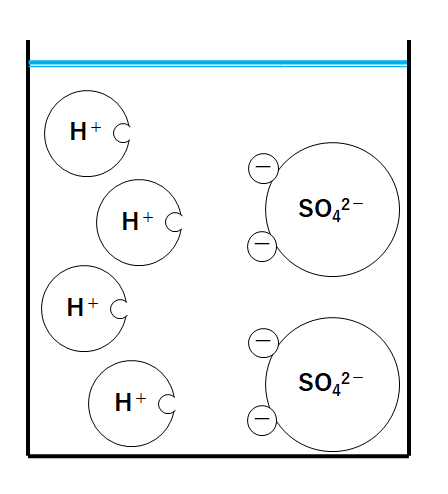
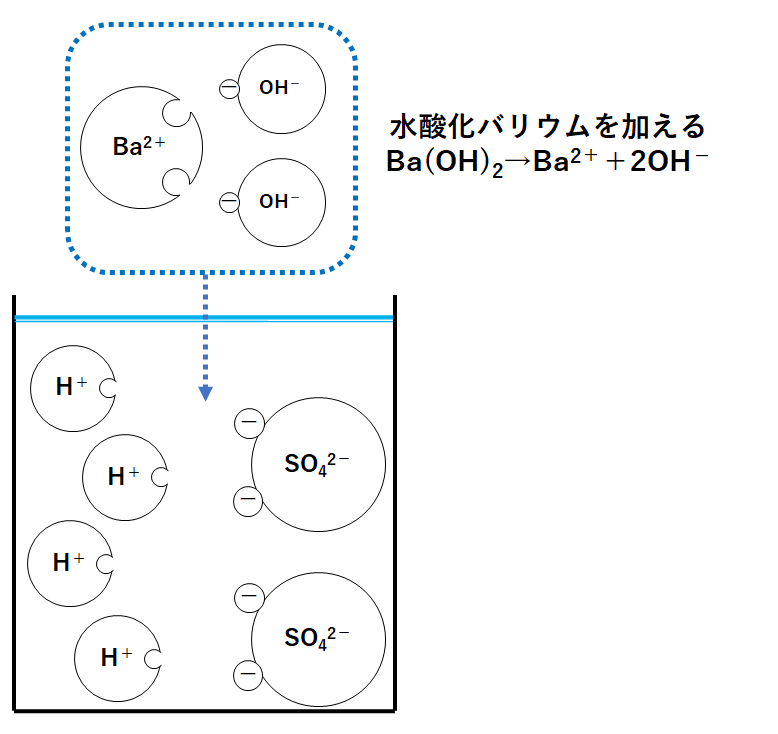
①ビーカーにうすい硫酸のみが入っているとき
硫酸は次のように電離しています。
H2SO4→ 2H++ SO42-
(水素イオンH+と硫酸イオンSO42-の個数比が2:1になっています)
水素イオンH+が4個、硫酸イオンSO42-が2個入っています。
(あくまでモデル、たとえです。こんなにイオンが少ないことは実際にはほぼありえません。)
水素イオンH+があるので溶液は酸性を示します。
よってBTB溶液は黄色になります。
②水酸化バリウム水溶液を少し加えたとき
ではここで水酸化バリウム水溶液を加えてみます。
水酸化バリウムBa(OH)2は、水溶液中で次のように電離しています。
Ba(OH)2→ Ba2++ 2OH-
(バリウムイオンBa2+と水酸化物イオンOH-が個数比1:2になっています)
いまBa2+1個とOH-2個のセットを加えたとしましょう。
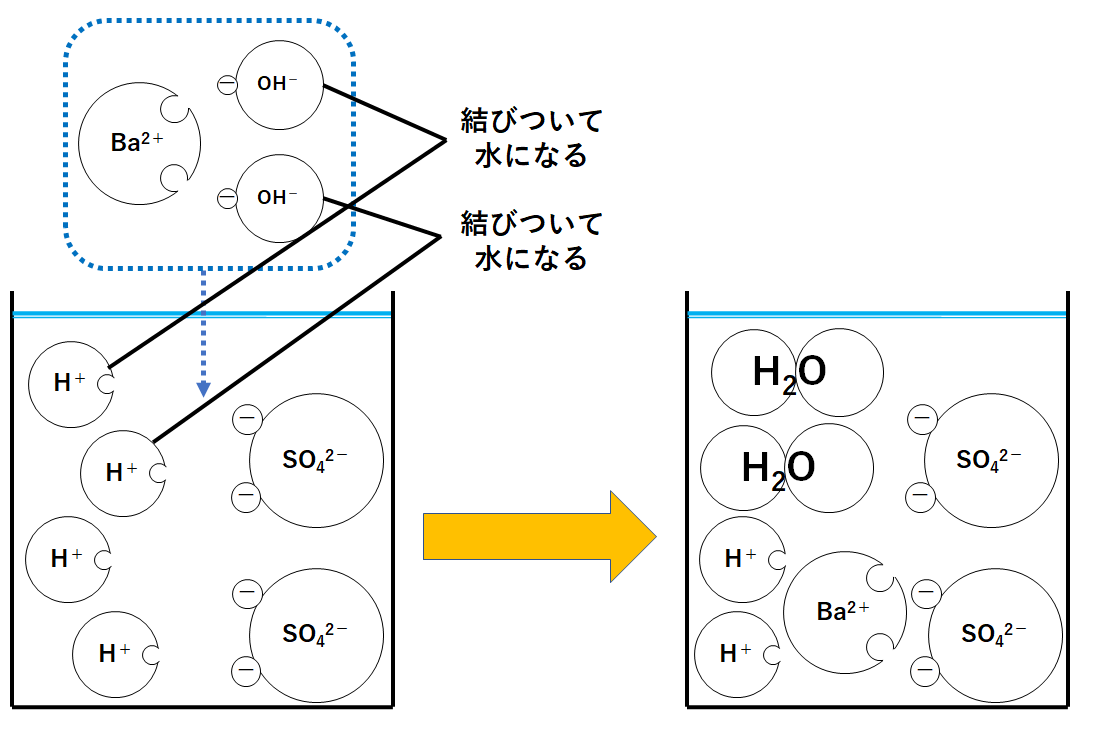
ここでH+とOH-が結びついて水H2Oになります。
つまり中和が起こります。(↓の図)
同時にBa2+とSO42-が結びついて硫酸バリウムBaSO4が生じます。(↓の図)
この硫酸バリウムは水に溶けません。(水に溶けない塩)
そのためビーカーの底に沈殿します。(色は白色)
このとき水素イオンH+があるので溶液全体は酸性を示します。
よってBTB溶液は黄色のままです。(少し黄色はうすまる)
③水酸化バリウム水溶液をさらに加えたとき
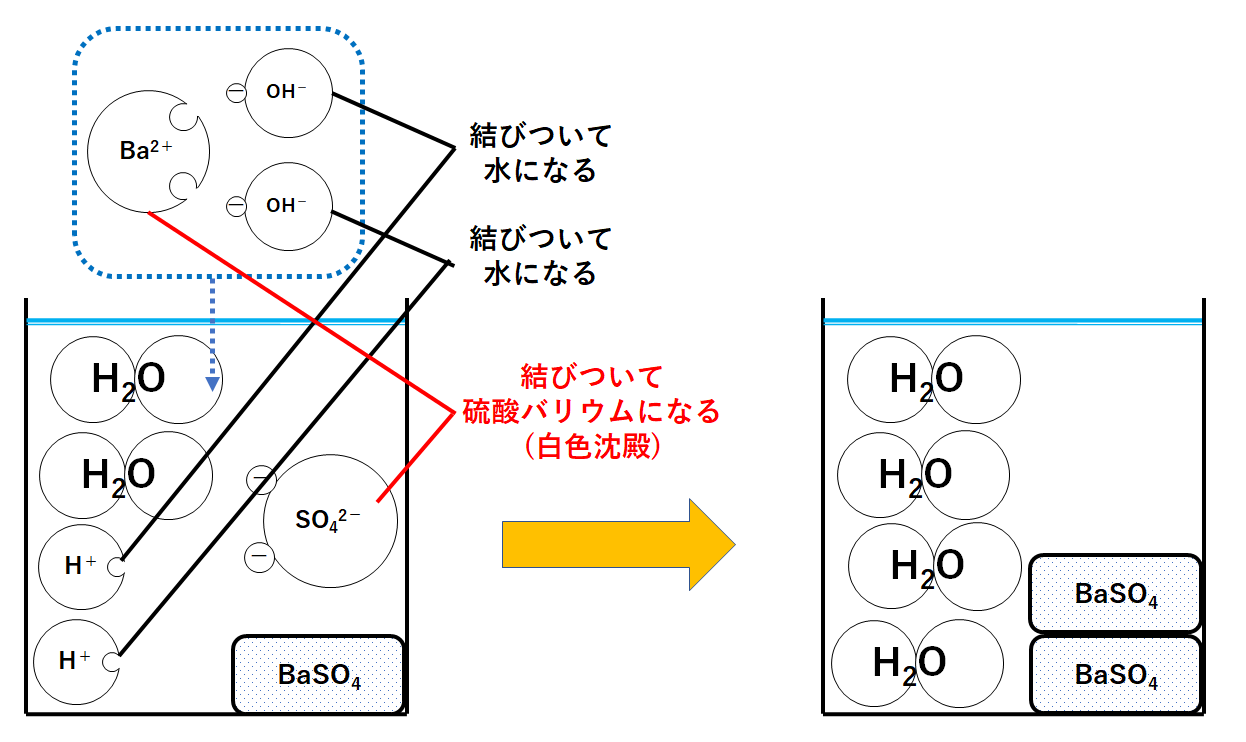
さきほどのビーカーに、さらにBa2+1個とOH-2個のセットを加えたとします。
①と同様にH+とOH-が結びついて水H2Oになります。
つまり中和が起こります。
同時にBa2+とSO42-が結びついて硫酸バリウムBaSO4が生じます。(↓の図)
このときビーカーにはH+もOH-も存在しません。
よって酸性でもアルカリ性でもなく、中性ということになります。
つまりBTB溶液は緑色に変化します。
④水酸化バリウム水溶液をもう一度加えたとき
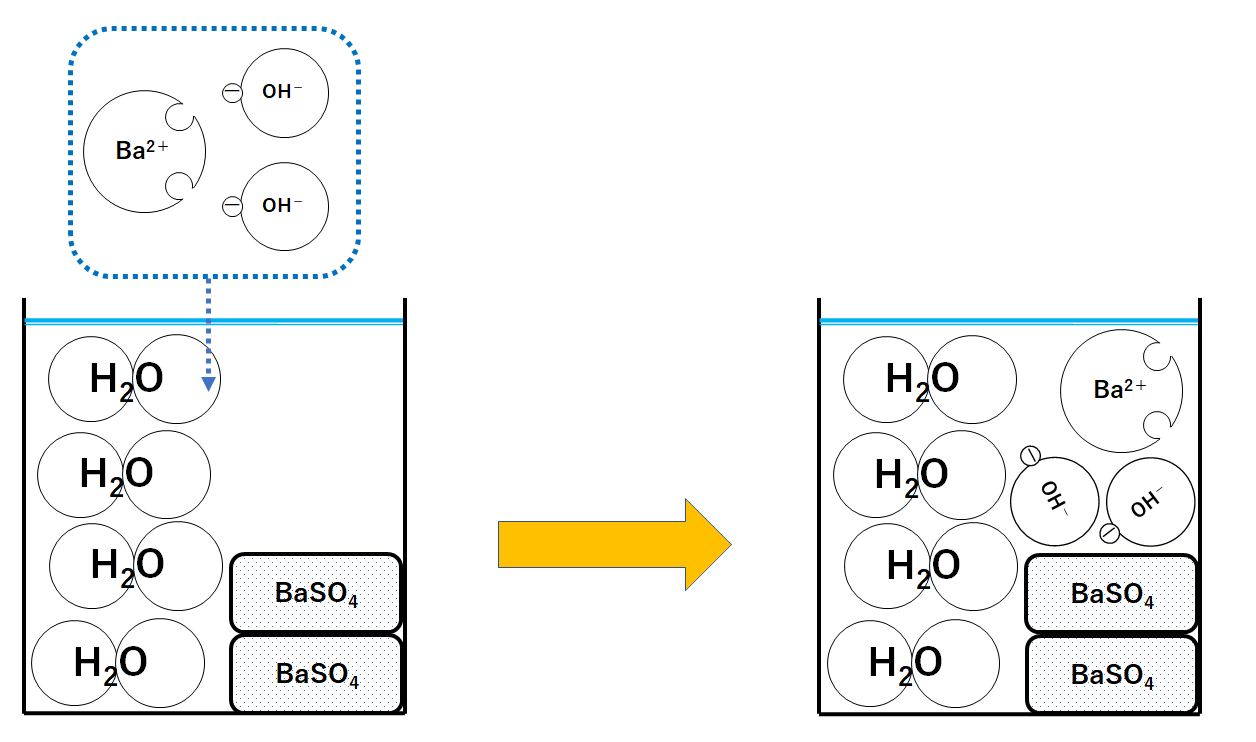
そして、さらにBa2+1個とOH-2個のセットを加えたとしましょう。
③の時点でH+がありません。
よってOH-はだれとも反応することなくそのままです。(中和は起こらない!)
また②が終わった時点ではSO42-もありません。
Ba2+もだれとも反応することもなくそのままです。(↓の図)
このときビーカーにはOH-が存在します。
つまり溶液はアルカリ性を示します。
BTB溶液は青色へと変化します。
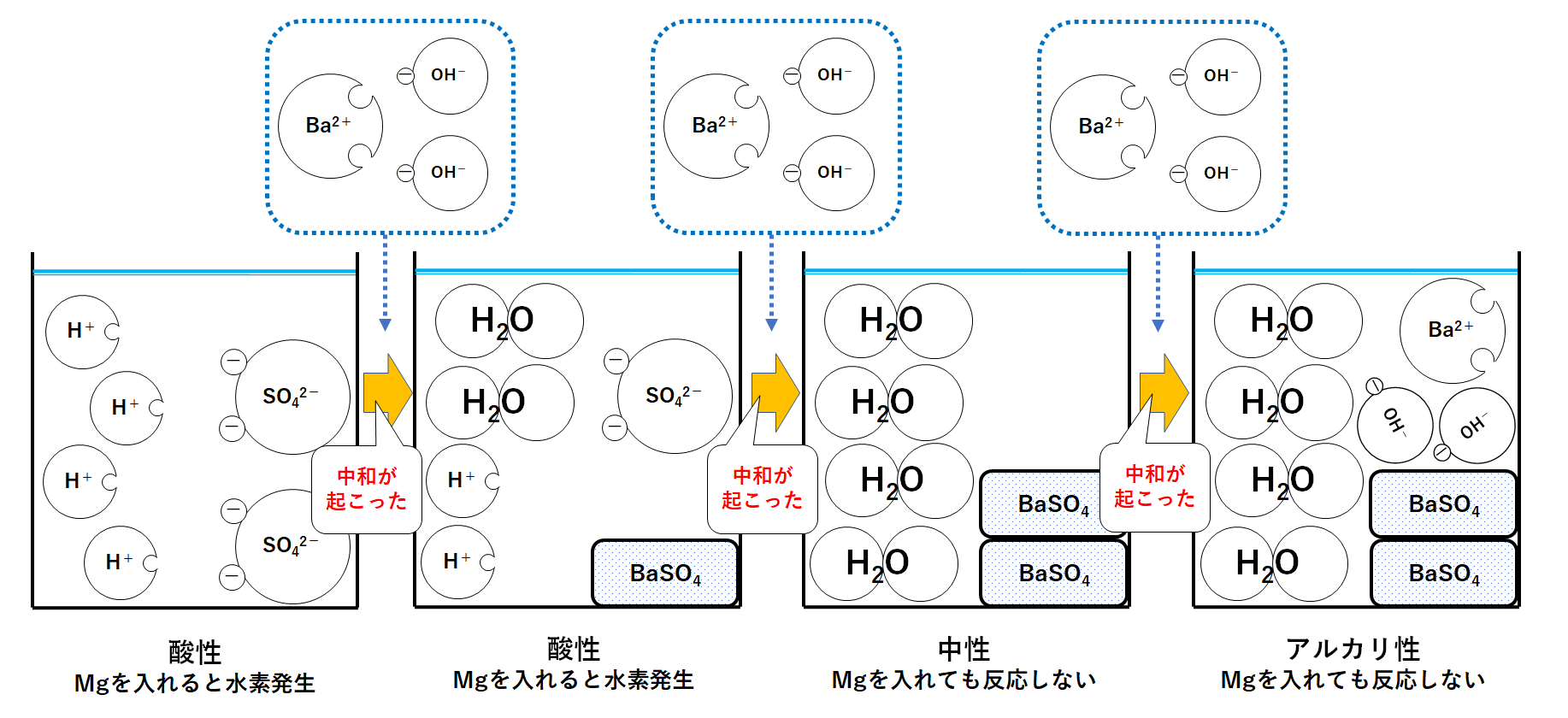
まとめ
それぞれのビーカーの液性は↑の図の通り変化していきます。
また酸には次の性質があります。
→ 金属と反応して水素を発生させる
そのため図の左側2つのビーカーにマグネシウムなどの金属を加えると、水素を発生させながら溶けます。
各イオンの数の変化
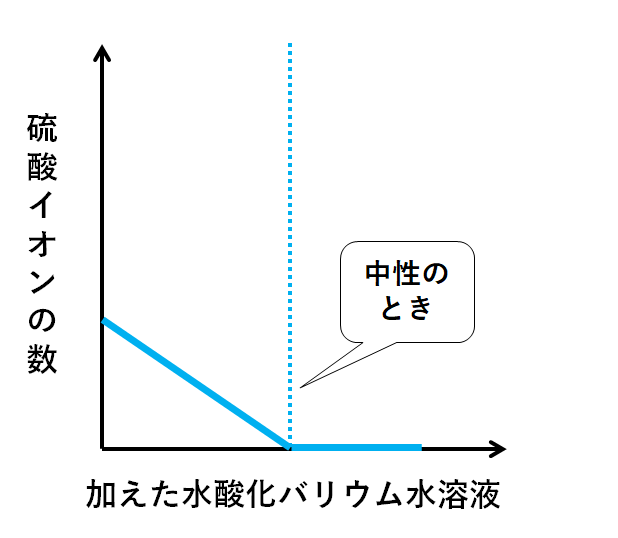
各イオンの数の変化をグラフにまとめてみましょう。

はじめ、Ba2+はSO42-と結びついてBaSO4になってしまいます。
よってビーカーにはBa2+は残らないことになります。
しかしSO42-がなくなった時点で、Ba2+はだれとも反応できなくなります。
そのためビーカーにそのまま余っていく(増加していく)ことになります。
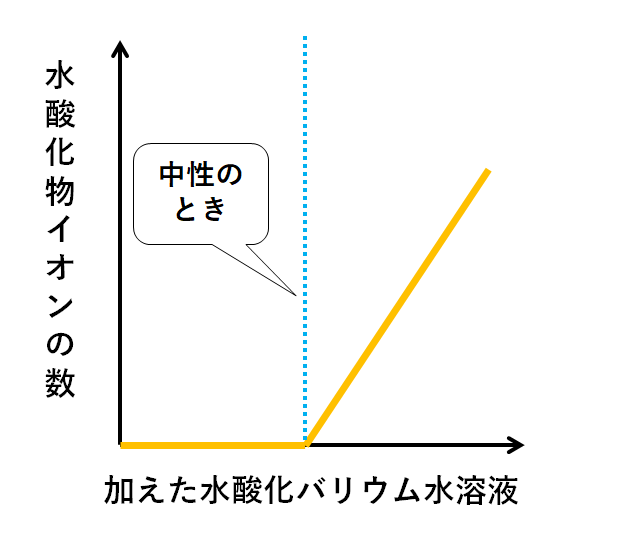
はじめOH-はH+と結びついてH2Oになってしまいます。
よってビーカーにはOH-は残らないことになります。
しかしH+がなくなった時点で、OH-はだれとも反応できません。
そのためビーカーにそのまま余っていく(増加していく)ことになります。
イオンの総数・電流
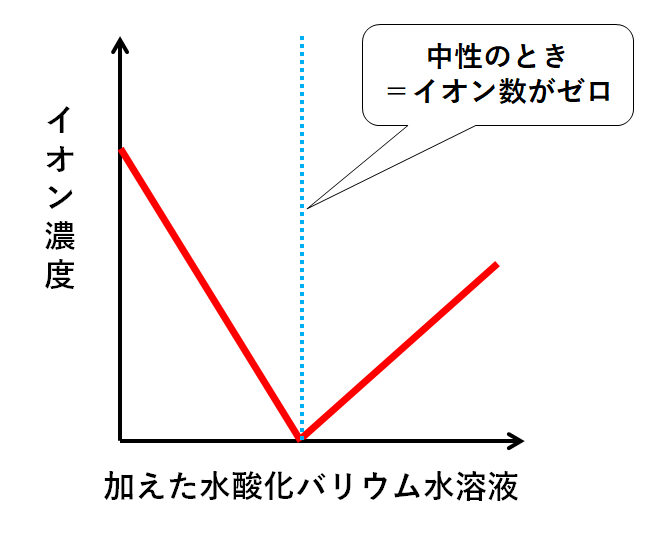
先ほどの4つのグラフ(H+・SO42-・Ba2+・OH-)を1つの図にまとめましょう。(↓の図)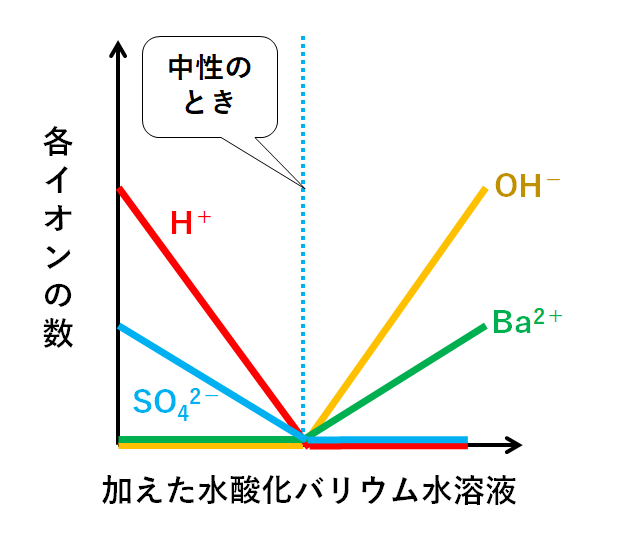
このグラフの注意点。
硫酸は次のように電離しました。
H2SO4→ 2H++ SO42-
つまりH+とSO42-の個数比が2:1です。
よってH+はSO42-の2倍存在するのです。
水酸化バリウム水溶液も同様です。
電離のようすは次のようになります。
Ba(OH)2→ Ba2++ 2OH-
つまりBa2+とOH-の個数比が1:2です。
よってOH-はBa2+の2倍存在するのです。
このためそれぞれのグラフの傾きが異なるのです。
そして重要なのは、中性のときイオンの総数が0個ということです。
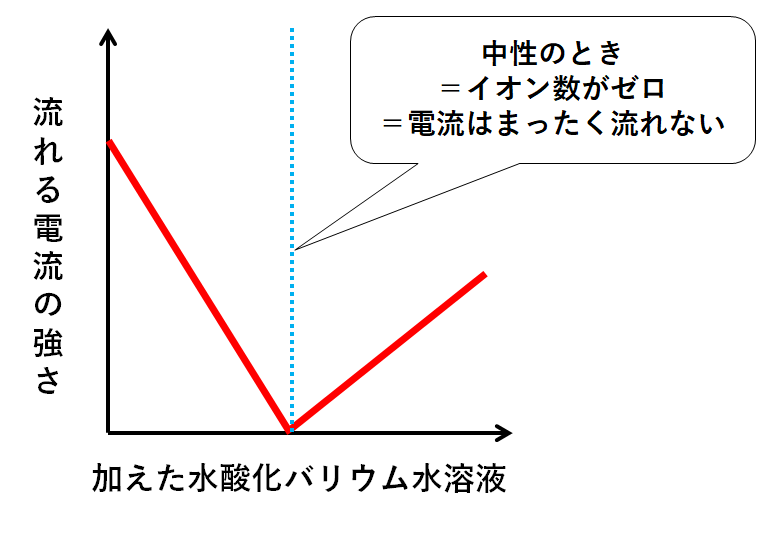
イオン濃度は電流の流れやすさに影響します。
イオン濃度が高いほど電流は流れやすいです。(電子の受け渡しをしやすい)
水酸化バリウム水溶液を加えた直後の溶液に電流を流したときのグラフは↓のようになります。
中性のとき、イオンの総数は0個なので、電流を通しません。
ここは必ず押さえておきましょう。
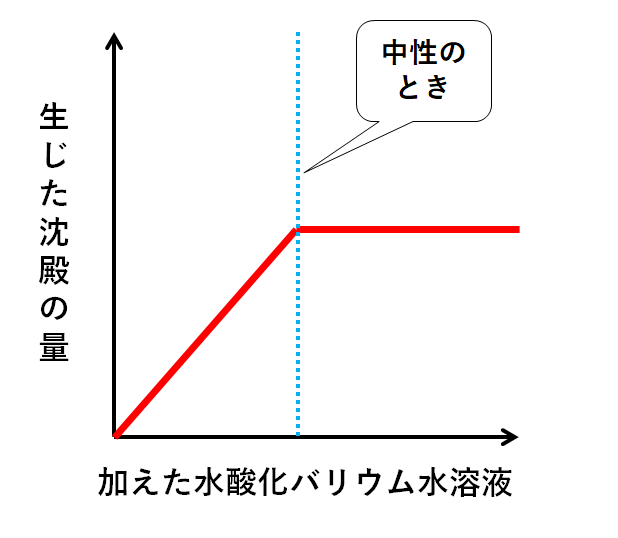
生じた沈殿(硫酸バリウム)の量
生じた硫酸バリウムのグラフは↓のようになります。
中性の時点でビーカーにはH+もSO42-もありません。
それ以降、水酸化バリウム水溶液を加えても硫酸バリウムは生じません。
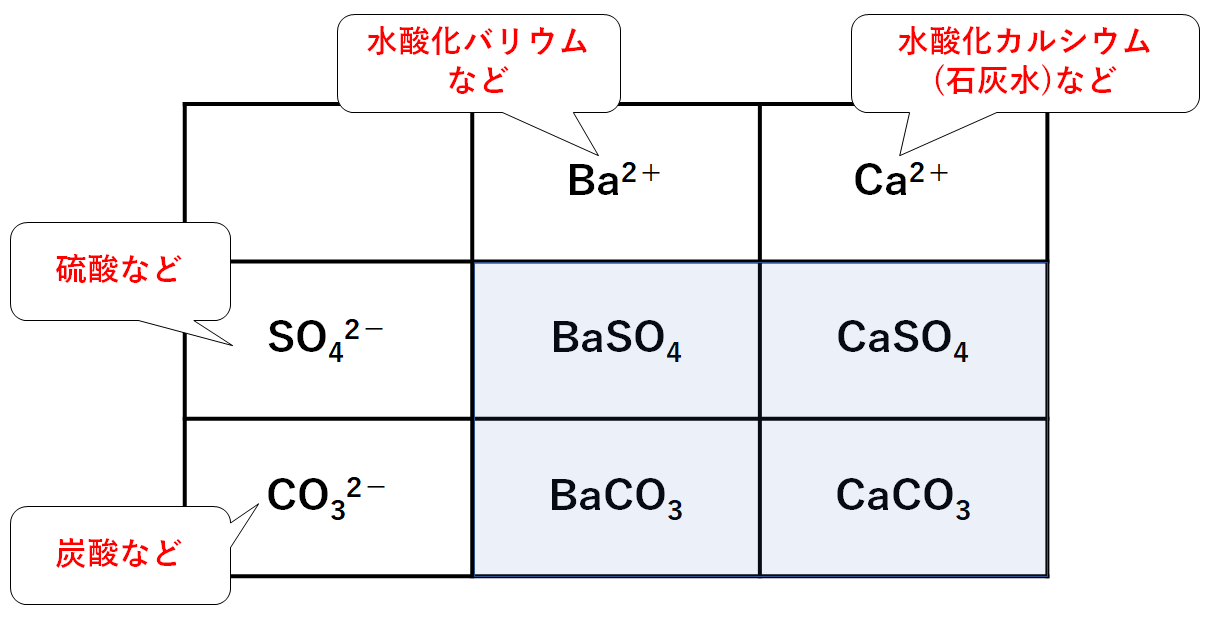
3.沈殿が生じる組み合わせ
塩酸と水酸化ナトリウム水溶液の中和では塩化ナトリウムという塩ができました。
塩化ナトリウムは水に溶ける塩です。
一方、硫酸と水酸化バリウム水溶液の中和。
このとき生じた塩は硫酸バリウム。
水に溶けない塩です。(沈殿となりビーカーの底にたまる)
ほかにも水に溶けない塩(沈殿)ができる組み合わせがあります。
どれも白色の沈殿です。
この4つについては覚えておいてもいいかもしれません。
POINT!!
・各イオンの数の変化のグラフをイメージできるように。
・生じる塩が水に溶けず、沈殿としてビーカーの底にたまる場合、中性のときに電流が流れない。
・しかし塩が水に溶ける場合、電流は流れにくいがゼロではない。
・つまり塩酸と水酸化ナトリウム水溶液の中和と、硫酸と水酸化バリウム水溶液の中和では・・・
→ 中性のときに電気を通すか、通さないかのちがいがある。




コメント(承認された場合のみ表示されます)