1.酸とは
■酸
電離して水素イオンH+を生じる物質。
■酸の性質
・電解質であり、その水溶液は電気を通す。
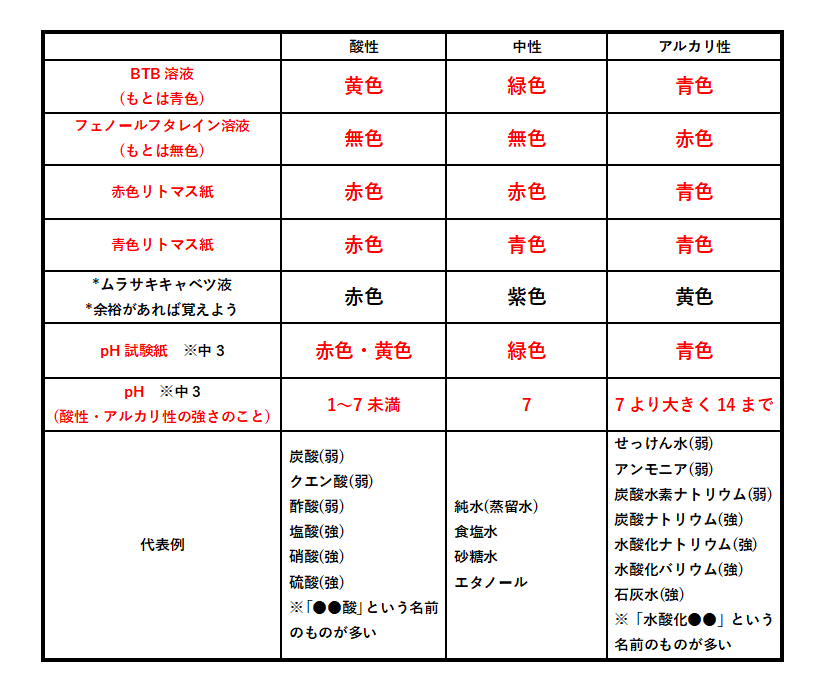
・BTB溶液が黄色に変化。
・青色リトマス紙が赤色に変化。
・多くの金属と反応し水素を発生させる。
■酸の代表例
名称が「○○酸」となっている。
▼主な酸とその電離式
塩酸:HCl → H++ Cl-
硫酸:H2SO4 → 2H+ + SO42-
硝酸:HNO3 → H+ + NO3-
酢酸:CH3COOH → H+ + CH3COO-
炭酸:CO2 + H2O → 2H+ + CO32-
すべて電離して水素イオンH+が生じている。
2.アルカリ
■アルカリ
電離して水酸化物イオンOH-を生じる物質。
■アルカリの性質
・電解質であり、その水溶液は電気を通す。
・BTB溶液が青色に変化。
・赤色リトマス紙が青色に変化。
・フェノールフタレイン溶液が赤色に変化。
・さわるとぬるぬるしている。
■アルカリの代表例
名称が「水酸化●●」となっているものが多い。
▼主なアルカリとその電離式
水酸化ナトリウム:NaOH → Na+ + OH-
水酸化バリウム :Ba(OH)2 → Ba2+ + 2OH-
水酸化カルシウム:Ca(OH)2 → Ca2+ + 2OH-
アンモニア :NH3 + H2O → NH4+ + OH-
すべて電離して水酸化物イオンOH-を生じている。
3.pH
■pH(ピーエイチ)
酸性、アルカリ性の強さを表すための数値。
酸のpHは7より小さい。
アルカリのpHは7より大きい。
中性の場合のpHはちょうど7。
※高校で学習しますが、水素イオンの濃度から計算される値はpHです。
■pH試験紙
その物質のpHによって色が変化する指示薬。
大まかにいうと
pHが7より低い(酸性のとき)・・・・・赤色や黄色
pHが7のとき (中性のとき)・・・・・緑色
pHが7より高い(アルカリ性のとき)・・青色
指示薬まとめ
4.酸とアルカリの実験
次のような装置を使って、
「酸には本当に水素イオンが関係しているのか?」
「アルカリには本当に水酸化物イオンが関係しているのか?」
を調べます。
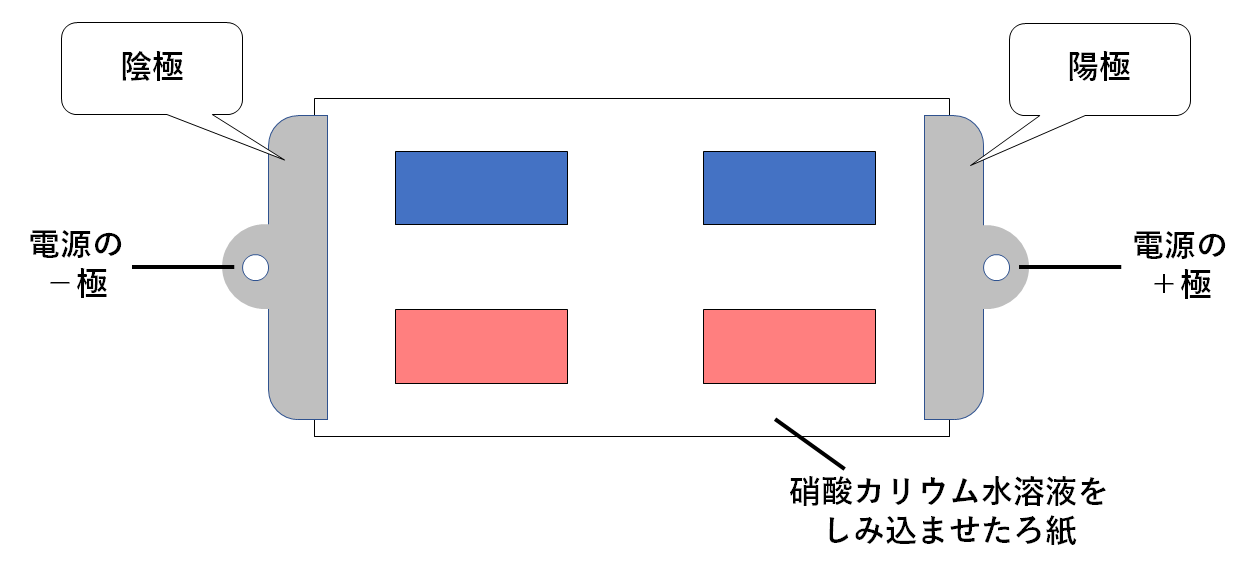
この装置は簡単な電気分解の装置のようなものです。
硝酸カリウム水溶液でしめらせたろ紙をクリップで止め、クリップに導線をつないでいます。
そこに赤色リトマス紙、青色リトマス紙を2枚ずつ置きます。
硝酸カリウム水溶液は電気を通しやすくするために用います。
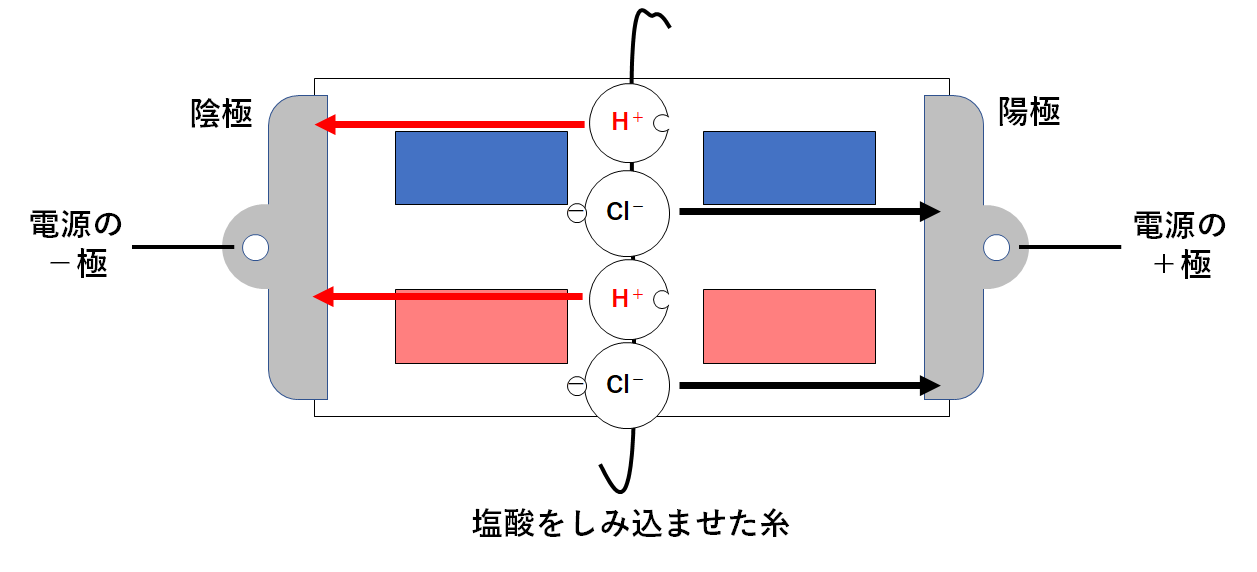
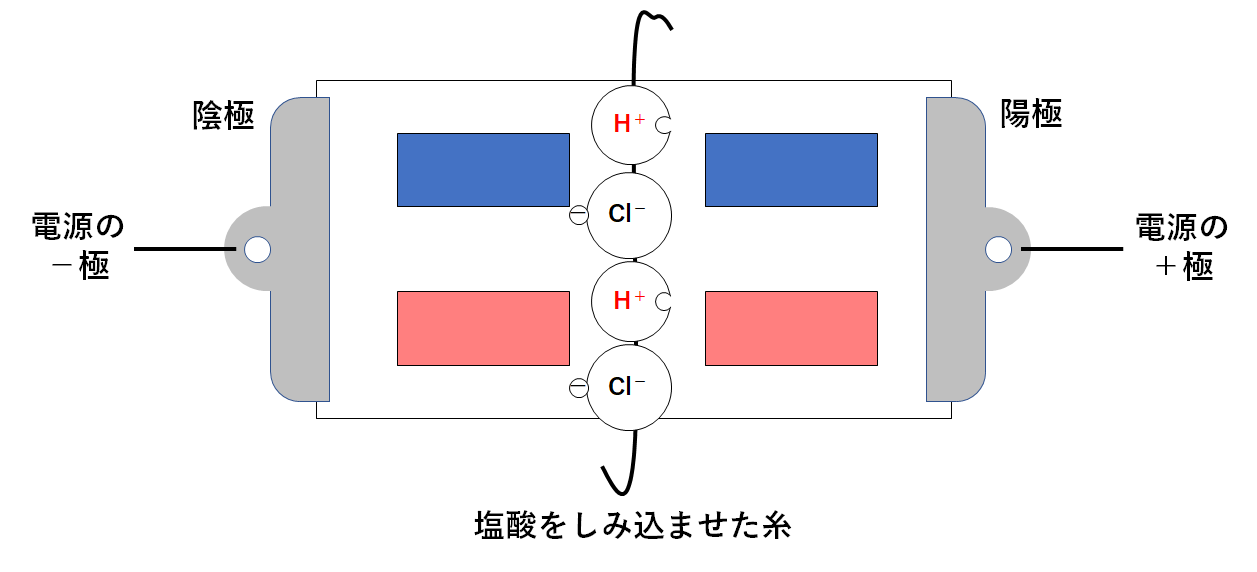
塩酸を使って実験を行った場合
↓の図のように真ん中に塩酸をしみこませた糸をたらしておきます。
塩酸の液中では、電離によって水素イオンと塩化物イオンが生じています。(↓の図)
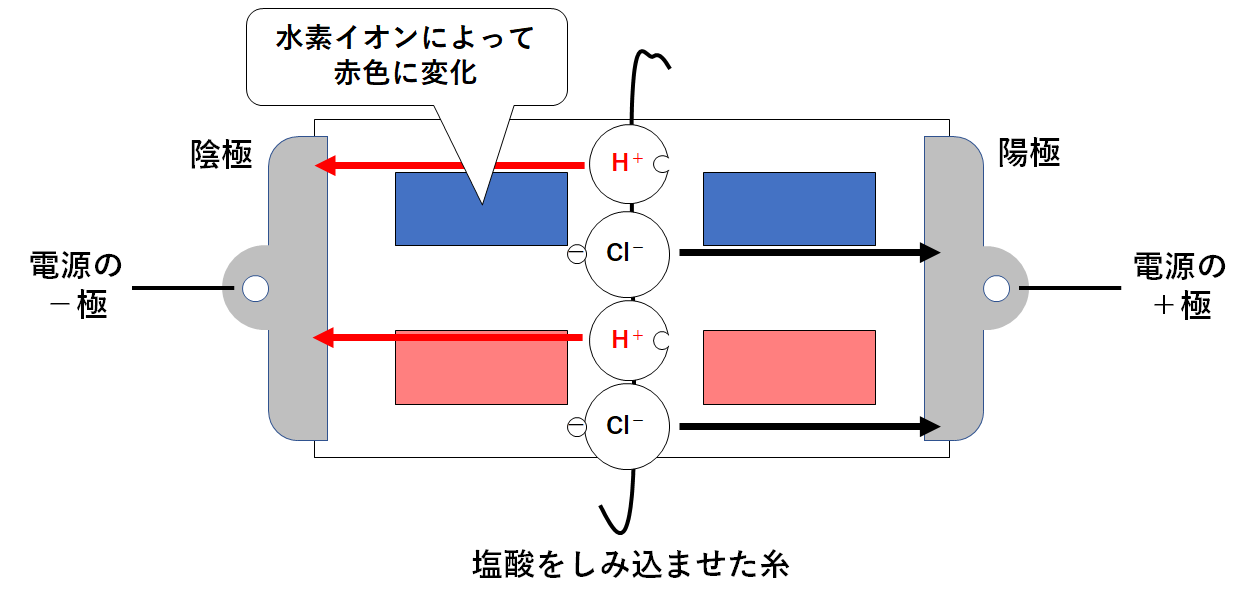
このとき、次のような変化が起こります。
陽極・・・陰イオンである塩化物イオンが近づく
陰極・・・陽イオンである水素イオンが近づく (↓の図)
水素イオンには、青色リトマス紙を赤色に変える力があります。
よって左上の青色リトマス紙が赤色に変化するのです。(↓の図)
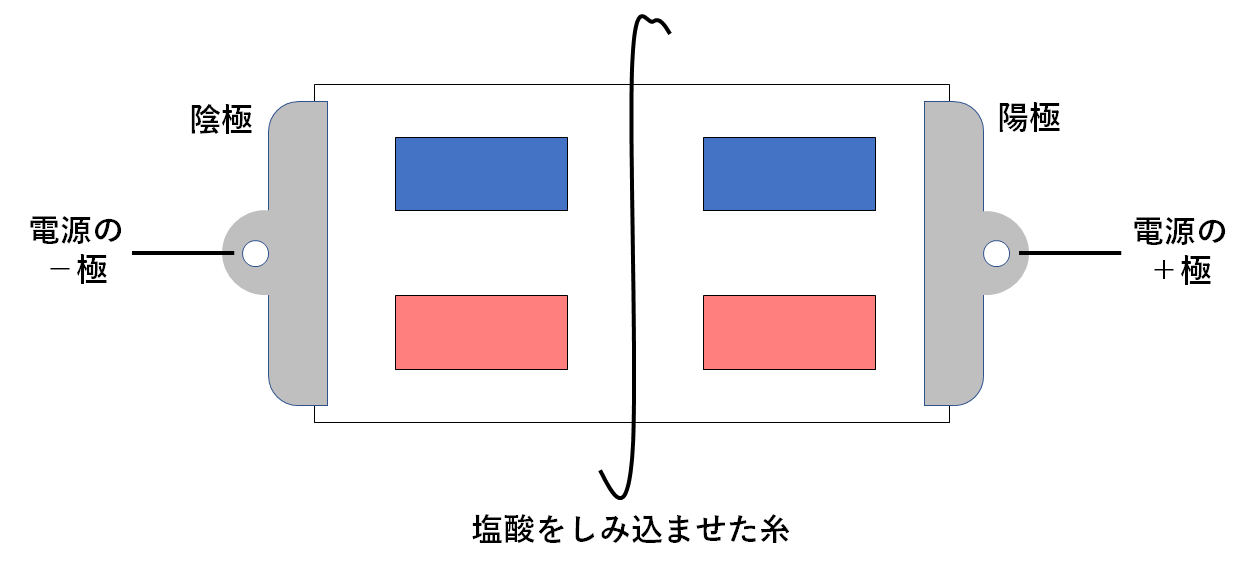
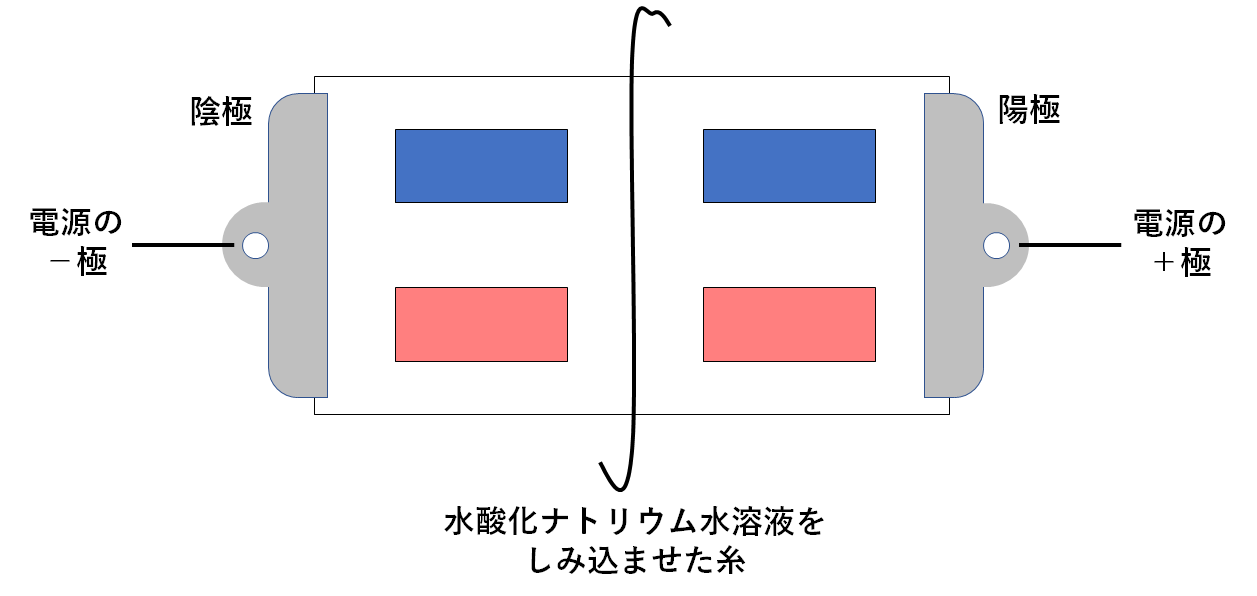
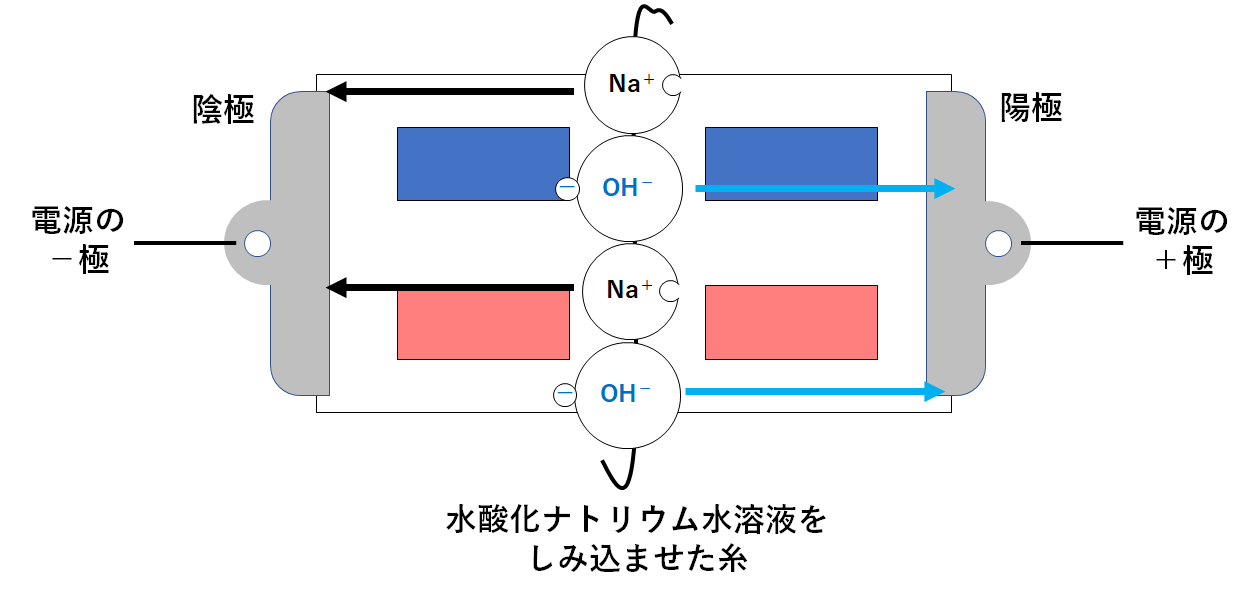
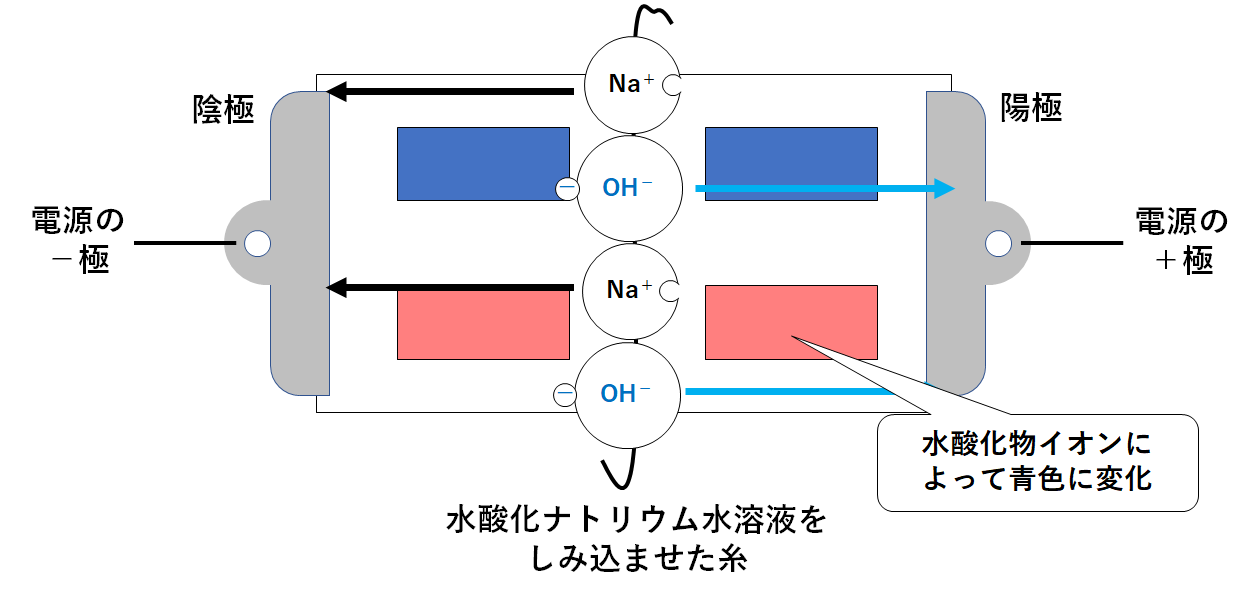
水酸化ナトリウム水溶液を使って実験を行った場合
↓の図のように真ん中に水酸化ナトリウム水溶液をしみこませた糸をたらしておきます。
水酸化ナトリウム水溶液には電離によってナトリウムイオンと水酸化物イオンが生じています。(↓の図)
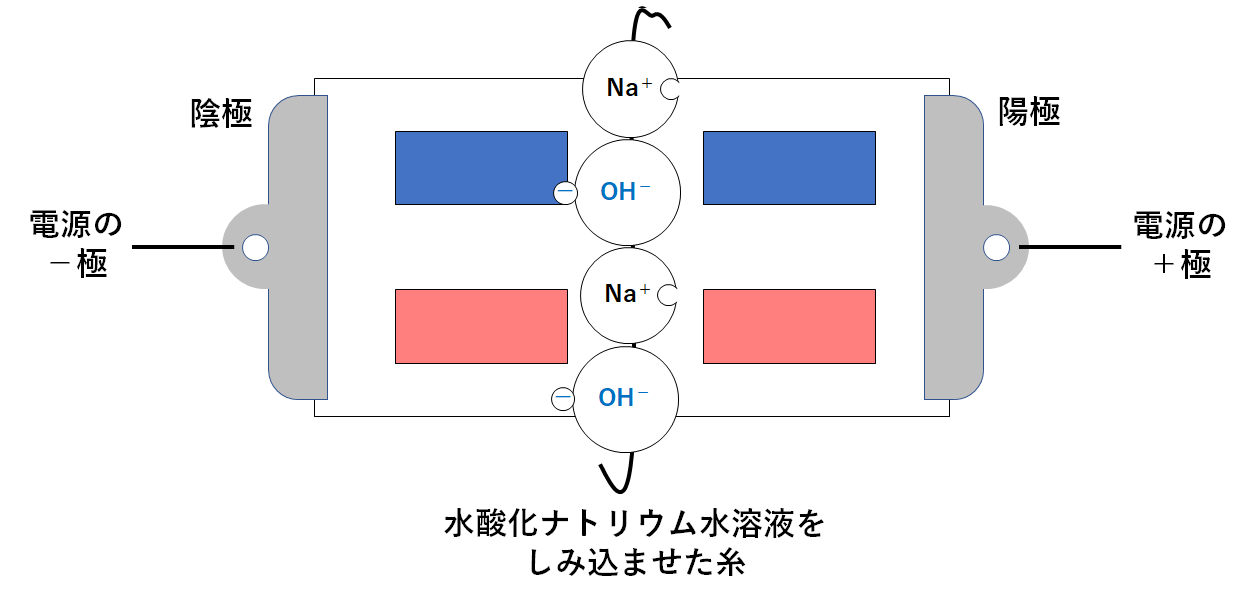
このとき、次のような変化が起こります・
陽極・・・陰イオンである水酸化物イオンが近づく
陰極・・・陽イオンであるナトリウムイオンが近づく (↓の図)
水酸化物イオンには赤色リトマス紙を青色に変える力があります。
よって左上の赤色リトマス紙が青色に変化するのです。(↓の図)
POINT!!
・酸・・・電離して水素イオンを生じる物質のこと!
・アルカリ・・・電離して水酸化物イオンを生じる物質のこと!
・BTB溶液、フェノールフタレイン溶液、リトマス紙の色の変化は必ず覚えよう!

コメント(承認された場合のみ表示されます)
酸性とアルカリ性の共通している存在はなんでしょうか?
ぺぱ様
コメントありがとうございます。
酸性の水溶液には水素イオンが、アルカリ性の水溶液には水酸化物イオンが共通して存在しています。
酸性とアルカリ性の両方に共通しているイオンはありません。
すごいわかりやすい。
ありがとうございます
え様
うれしいコメントありがとうございます。
またいつでもご覧ください。
学校で2、3時間かけて勉強するよりわかりやすいです!テスト勉強が捗りました!感謝です🙏🙏🙏
今年中3の下ぶちメガネ様
コメントありがとうございます。
わかりやすいと言っていただけてとてもうれしいです。
ご理解のお役に立てていれば幸いです。
またぜひご覧ください。