高校入試の理科では
・物理(光や運動・力・電流回路)
・化学(水溶液や状態変化・化学変化)
・生物(植物や動物・遺伝)
・地学(地震・地層・天体・天気)
の4つの単元がバランスよく出題されます。
入試のときは、これらがバランスよく点数が取れれば言うことはありません。
しかし、いつもバランスよく、というわけにはいかないでしょう。
特に多くの高校入試では
「電流回路、運動や力などの物理」と「天体」
は難しい出題であることが多く、なかなか高得点は狙いにくいものです。
もちろんすべての高校入試がそうではありませんが、
一般的な傾向として「物理」と「天体」は高得点が出にくいです。
高得点が出にくい、ということは点差がつきにくい、ということでもあります。
1つの大問の中でも正解しやすい問題が限られているということですからね。
では、他の受験生と差をつけるためにはどの単元がねらい目か??
それは「化学変化」です。
なぜなら「化学変化」の問題にはバリエーションがあまりありません。
出題のパターンが限られているのです。
これはそこそこ難しい私立の高校入試でもそうです。
「この問題見たことあるなあ」
化学変化は、たくさん勉強すればするほど、こういう感想になっていきます。
もちろん習得には、それなりに問題を解かなければなりません。
しかしマスターしてしまうと、一気に得点源になりえる単元なのです。
さて、このページでは化学変化の問いを解くコツについて紹介します。
そもそも化学変化って?
化学変化とは、性質の異なる物質ができる変化のこと。
中学校では
中2で化合、分解(熱分解や電気分解)、酸化や燃焼、還元
などを学習します。
ほかにも
中3で学習する電池(化学電池)、中和反応などのイオンが関わる反応も
化学変化と言えます。
また
中1で学習する気体の性質なども化学変化の内容が含まれています。
中2で学習しますが、化学変化とは
物質をつくる原子同士の組み合わせが変わる変化
とも言えます。
そのため元素記号や化学式は必ず覚えましょう。
そして化学反応式の書き方もマスターしましょう。
この知識は中学だけではなく、高校化学を勉強するうえでの土台になりますし、大学の研究でも当たり前に出てくることがらばかりです。
しっかりマスターしておきましょう。
化学変化の問題の解法
化学変化の問題の多くは次の流れで解きます。
手順1 どのような反応が起こっているかチェック。
手順2 どのような比で反応が起こるかチェック。
手順3 比をもとに計算する。
まず手順1について。
問題文をよく読んで、どのような化学変化が起こっているかチェック。
「水素と酸素が反応して水ができているな」とか
「炭酸水素ナトリウムが分解して炭酸ナトリウムと水と二酸化炭素ができているな」とか
何と何が反応して、結果として何が生じたのかを必ず確認。
化学反応式で書いておくとよりGood。
※よく出る反応の化学反応式はこちら→【化学反応式まとめ】←
次に手順2について。
反応のようすがわかれば、次に計算の準備です。
計算のときに必要なのは
反応するときの物質の量の比
です。
これは
・問題文にそのまま書かれている場合
・グラフにそのまま書かれている場合
・問題文やグラフ、表から読み取る場合
の3パターンに分かれます。
1つ1つ例を見てみましょう。
1.問題文にそのまま書かれている場合
” アルミニウム2.7gを加熱すると酸化物が5.1gできた。”
この問題文から
アルミニウム+酸素→酸化アルミニウム
の化学変化が起こっており、
その質量比は
アルミニウム:酸素:酸化アルミニウム
=2.7:(5.1-2.7):5.1
=2.7:2.4:5.1
=9:8:17
とわかります。
このように問題文に書かれている数字をそのまま利用すればよいのです。
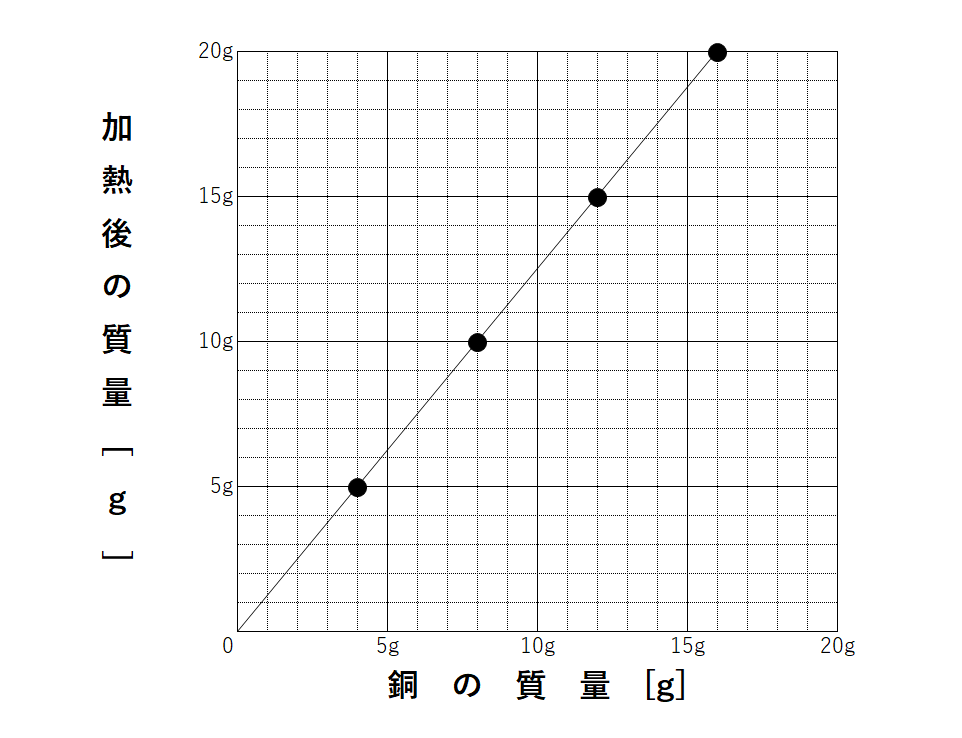
2.グラフにそのまま書かれている場合
” 次のグラフはさまざまな質量の銅を加熱したときにできる酸化物の質量についてまとめたものである。”
この問題文から
銅+酸素→酸化銅
の化学変化が起こっていることがわかります。
そして、その質量比はグラフより
銅:酸素:酸化銅=4:1:5
とわかります。
このようにグラフ上の点の座標を見て、その数字をそのまま利用すればよいのです。
3.問題文やグラフ、表から読み取る場合
一番やっかいなのはこのパターンです。
比を自分で探し当てなければならないのです。
しかし、「比を探し当てる」のは高校入試で、もう何度も何度も出題されてきました。
つまり、パターンは限られています
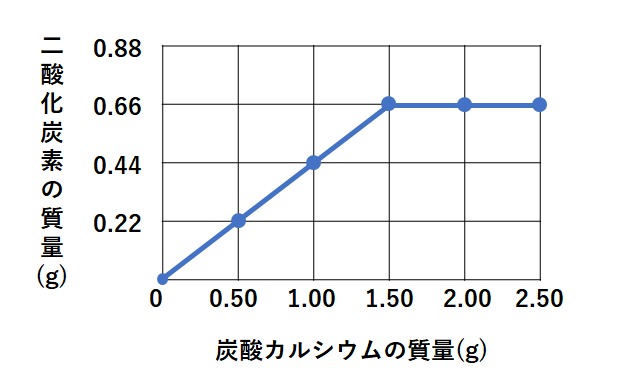
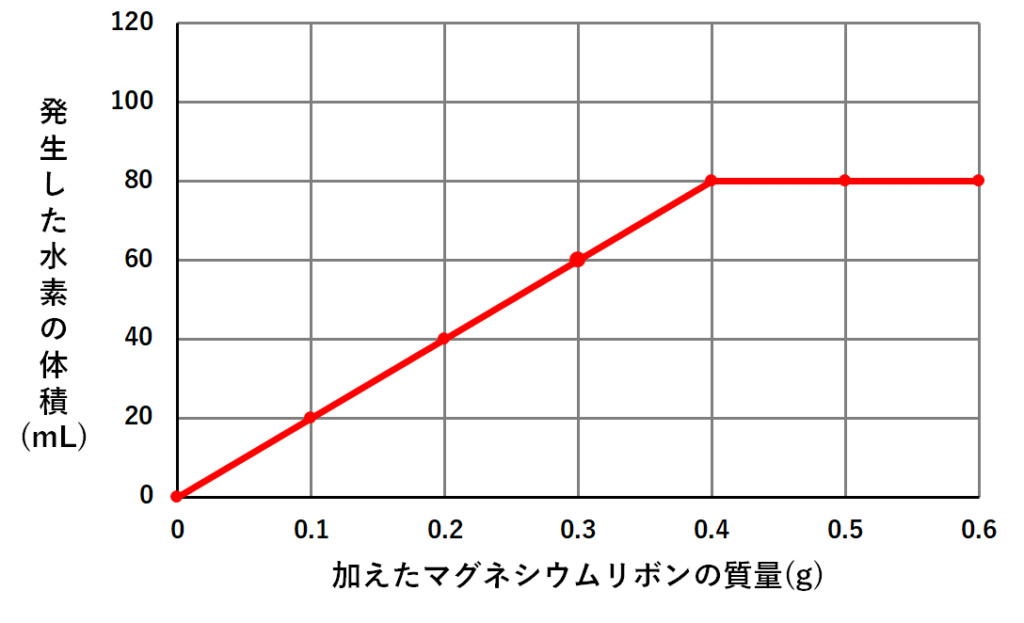
■探し当てパターン① グラフの折れ曲がり点に注目!
例えば、石灰石と塩酸が反応する問題や金属と塩酸が反応する問題では↓のようなグラフが良くあります。
この場合の反応の比は、折れ曲がり点の座標をチェックします。
※詳しくは→【気体の発生の計算】←を参考に。
■探し当てパターン② 気体の反応の場合は気体反応の法則
気体どうしの反応の場合は気体反応の法則を用います。
気体反応の法則とは・・・
気体どうしの反応における体積比は、化学反応式の係数比に等しい
というもの。
(体積比という点に注意、質量比ではありません。)
例えば水素の燃焼。
これは次の化学反応式で表されます。
2H2 + O2 → 2H2O
その係数比から
水素:酸素=2L:1L
の体積比で反応することがわかります。
また次のような反応。
N2 + 3H2 → 2NH3
窒素と水素が反応してアンモニアが生じる反応です。
中学ではあまり見ません。(高校で学習します)
よく知らない反応でも化学反応式の係数比から
窒素:水素:アンモニア=1L:3L:2L
の体積比で反応することがわかります。
気体反応の法則、学校ではあまりやりません。
ですが、難しい問題を解くには重要な法則です。
※詳しくは→【気体反応の法則】←を参考に。
■探し当てパターン③ 原子1個の質量比を利用
いちばん高度な問題です。
原子1個の質量比を利用します。
” 炭素原子1個と酸素原子1個の質量比は3:4である。”
この事実を利用すると質量比を考えることができます。
例えば炭素の完全燃焼。
まず化学反応式は
C +O2 → CO2
左辺には炭素原子が1個、酸素原子が2個です。
先ほどの質量比をあてはめると
炭素:酸素:二酸化炭素=3:8:11
の質量比で反応するとわかります。
このように問題文に原子1個の質量比が与えられれば、
化学反応式さえ書くことができれば、反応の際の質量比はわかります。
※詳しくは→【原子1個の質量】←を参考に。
最後に手順3について。
比を使って計算していきます。
ここでの主な出題パターンは4つ。
①比に基づいて、比例式を立てて計算する問題。
一番多い問題です。
手順2で得られた比から
4:1=1.2:x
のような比例式を立てましょう。
②未反応のものがある問題。
“燃焼した○○のうち一部が反応し・・・”
“加熱した△△のうち、一部が酸化されて・・・”
→【定比例の法則(酸化)】←を参考に。
「連立方程式を立てる」または「図を書いて考える」の2つの解法があります。
③混合物を反応させている問題。
“○○と△△の混合物3.5gを加熱し・・・”
→【定比例の法則(酸化)】←を参考に。
こちらは混合した物質をx、yとおいて連立方程式を立てます。
④過不足のある計算問題。
“ マグネシウムと塩酸のうちどちらが反応せずに残るか ”
→【気体の発生の計算】←に書いてある「うどんの計算法」を使います。
まとめ
化学変化の問題は以上のパターンの組み合わせにすぎません。
そのため、きちんと知識を得て、問題演習をすれば、得点源になりうる単元です。
理科が苦手教科だ、という人も、化学変化の問題を習得できれば、”理科で稼ぐ”ことさえできる可能性もあります。
もう一度まとめておくと
・必ず元素記号・化学式は覚えておく。
・化学反応式の書き方をマスター。
・化学変化の計算問題は
①「反応のようすを把握する」
②「比を調べる」
③「比を使って計算する」
の3手順で解ける。
これを踏まえて、たくさんの問題練習をしてくださいね。

コメント(承認された場合のみ表示されます)