このページでは「アボガドロの法則」「気体反応の法則」について解説しています。
中学校ではあまり学習しない内容です。
そのため、やや発展的な内容を含みます。
化学反応式についての理解は必須です。(→【化学反応式】←を参考に。)
1.アボガドロの法則と気体反応の法則
同じ圧力、同じ温度、同じ体積のすべての種類の気体には同じ数の分子が含まれる。
例えばある温度、ある気圧のもとで
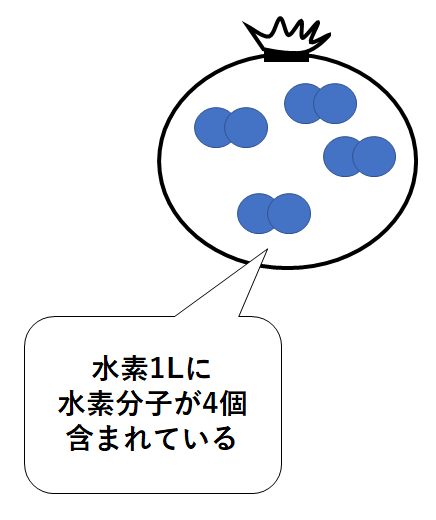
水素の気体1Lには4個の水素分子が含まれていたとします。(↓の図)
同じ温度、同じ気圧のもとでは
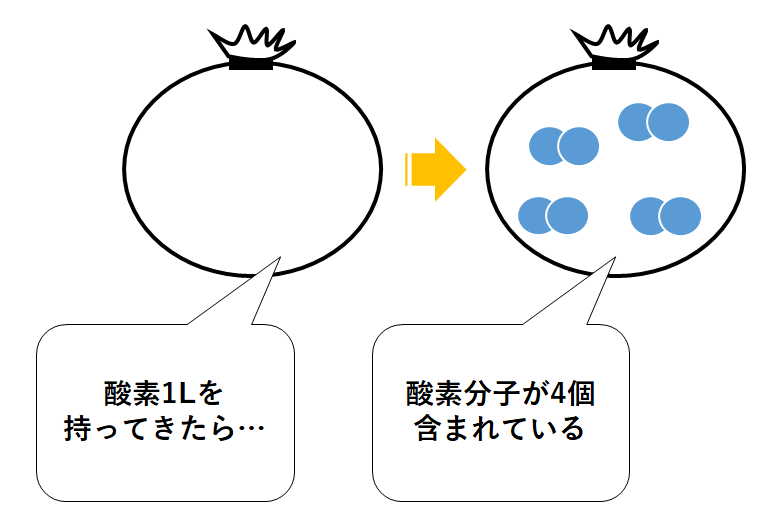
酸素の気体を1L取ってきたら、その中には酸素分子は4個含まれる。(↓の図)
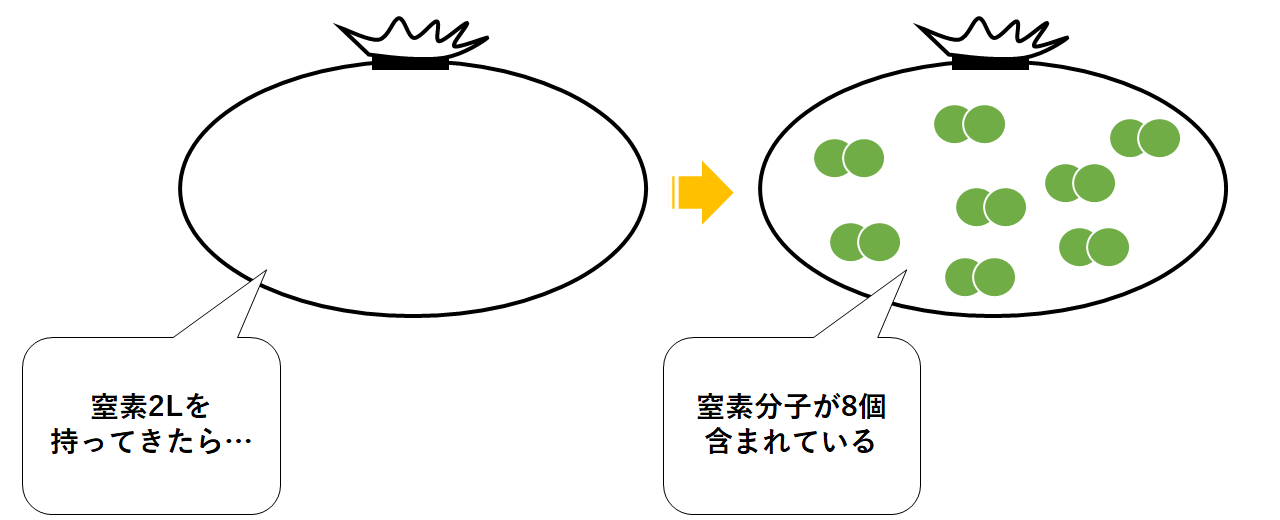
窒素の気体を2L取ってきたら、その中には窒素分子は8個含まれる。(↓の図)
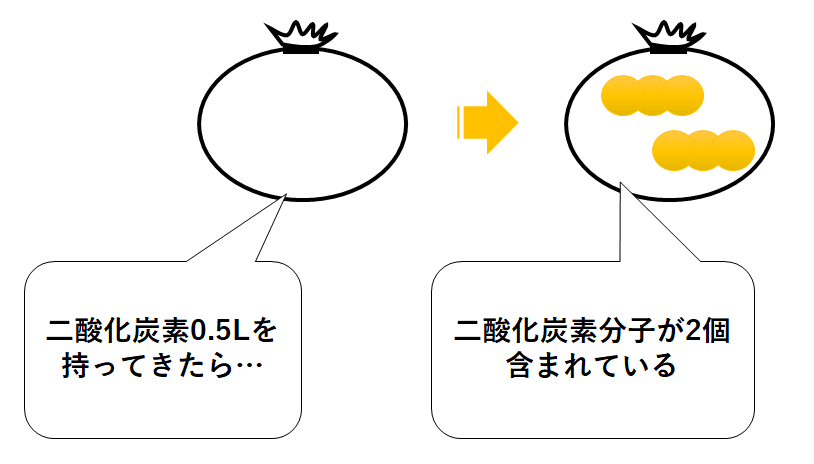
二酸化炭素の気体を0.5L取ってきたら、その中には二酸化炭素分子は2個含まれる。(↓の図)
ということになります。
つまり同じ温度、同じ気圧のもとでは
気体の種類を問わず、気体の体積と気体の分子数が比例するということです。
ほかの言い方をすると・・・
同じ温度、同じ気圧のもとで
同数の分子をふくむ気体Aと気体Bの体積は等しくなる
ということです。
同じ圧力、同じ温度のもとで、化学変化に関係する気体の体積には簡単な整数比が成り立つ。
例えば水素が燃焼して水蒸気ができるという反応を見てみましょう。
2H2 + O2 → 2H2O
この化学反応式の意味は
左辺:H2が2組・O2が1組
右辺:H2Oが1組
です。
2個の水素分子(H2)と1個の酸素分子(O2)が反応して
2個の水分子(H2O)ができる、
ということです。
これに先ほどのアボガドロの法則を組み合わせてみましょう。
いまある温度、ある気圧のもとで
水素の気体1Lがあり、この中には水素分子(H2)が2個含まれている
とします。
この水素の燃焼が一定の温度、一定の気圧のもとで行われたとすると、
アボガドロの法則より
1個の酸素分子(O2)・・・体積は1L
2個の水分子(H2O)・・・体積は2L (ただし水蒸気であるとする)
を意味することになります。
ということでこの化学変化では
水素の気体(H2)2L と 酸素の気体(O2)1L が 反応して 水蒸気(H2O)2L が生じた
ということになります。
アボガドロの法則と気体反応の法則をまとめると
化学変化に関係する気体の体積比や分子数比は、化学反応式の係数比に等しい
ということになります。
POINT!!
気体の反応では・・・
反応するときの*体積比は、化学反応式の係数比に等しい。
*質量(g)ではないことに注意!
2.気体の反応の例
では次の反応を見てみましょう。
アンモニアの生成(ハーバーボッシュ法)
化学反応式 N2 + 3H2 → 2NH3
窒素の気体(N2)と水素の気体(H2)が反応してアンモニアの気体(NH3)ができる
という意味の反応です。
この係数比は
N2:H2:NH3=1:3:2
になっていますね。
ということは
窒素の気体1Lと水素の気体3Lが過不足なく反応し、アンモニアの気体が2L生じる
ということです。
気を付けなければならないのは
窒素の気体1Lと水素の気体3Lが過不足なく反応
→ アンモニアの気体は1L+3L=4L生じる
と勘違いしてしまうことです。
ほかの反応を見てみましょう。
メタンの燃焼
化学反応式 CH4 + 2O2 → CO2 + 2H2O
メタンの気体(CH4)と酸素の気体(O2)が反応して二酸化炭素の気体(CO2)と液体の水ができる
という意味の反応です。
この係数比は
CH4:O2:CO2:H2O=1:2:1:2
になっています。
ということは
メタンの気体1Lと酸素の気体2Lが過不足なく反応し、二酸化炭素の気体が1L生じる
ということです。
ここで水が気体として生じるならばその体積は2Lですが、液体として生じるならばその体積は1Lではありません。
気体の反応を考えているということを忘れずに置きましょう。
POINT!!
気体が関わる化学変化では
化学反応式の係数比=反応する体積比
ということを利用して計算問題に取り組みます。
少しレベルが高いですが知っておきましょう。

コメント(承認された場合のみ表示されます)