このページでは「化学変化とは何か」「鉄と硫黄の化合」「銅と硫黄の化合」について解説しています。
分解について・・・→【分解】←
酸化について・・・→【酸化(燃焼)】←
還元について・・・→【還元】←
化学変化の計算については
→【質量保存の法則】← または →【定比例の法則(酸化)】← または →【気体の発生に関する計算】←
化学反応式について・・・→【化学反応式】←
で解説しています。
1.化学変化とは
物質をつくる原子の組み合わせが変化し、性質の異なる別の物質が生じること。
※組み合わせが変わるだけで、原子の数や種類は変化しない!
※化学変化の反対語は「物理変化」や「状態変化」。
状態変化は「分子どうしのつながりの強さ」が変わるだけで、原子の組み合わせが変化することはありません。
2.物質同士が結びつく反応
2種類以上の物質が結びついて1種類の物質になること。
※現在はあまり用いない用語となっています。(単体どうしが結びつく反応を化合と呼ぶ)
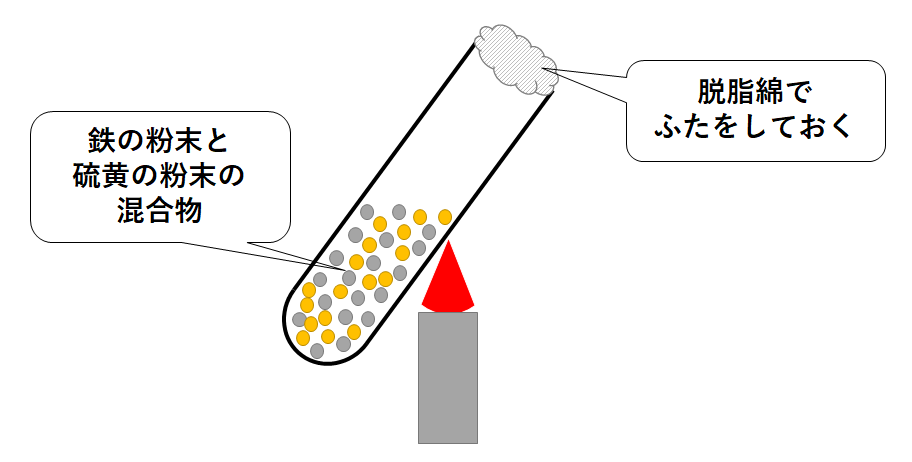
(例) 鉄と硫黄の結びつく反応
(反応のようす) 鉄+硫黄→硫化鉄
鉄と硫黄(黄色)の粉末を混ぜ合わせて加熱すると、鉄と硫黄は結びつき硫化鉄(黒色)となります。
・脱脂綿で軽くふたをしておきます。
⇒ 硫黄の蒸気や粉末が試験管外に出るのを防ぐため。
・鉄と硫化鉄はまったく性質が異なります。
※特に「 鉄 + 塩酸 → 水素 」「 硫化鉄 + 塩酸 → 硫化水素 」の反応は覚えること。
・鉄と硫黄の粉末を加熱すると、その反応により熱が発生します。(発熱反応)
・そのため、途中で加熱をやめても反応が続いていきます。
(例2)銅と硫黄の結びつく反応
(反応の様子) 銅 + 硫黄 → 硫化銅
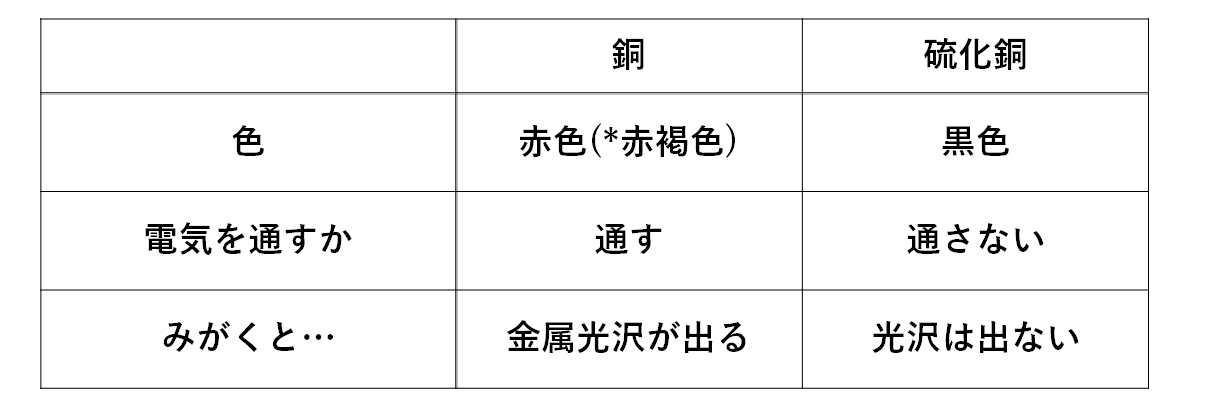
硫黄の蒸気の中に熱した銅板を入れるとはげしく化合の反応が起こります。そして硫化銅(黒色)ができます。
・銅と硫化銅は性質が全く異なります。
*銅の色はふつう「赤色」と出題されますが、場合によっては「赤褐色(せきかっしょく)」と表現されるときもあります。
・銅と硫化銅で共通するのはともに塩酸と反応しない、ということです。
(いっぱんに金属は塩酸と反応して水素を発生させるものが多い。)
・もう1つ共通するのはともに磁石に引き寄せられないということです。
(磁石に引き寄せられる金属は鉄・ニッケルなど限られた金属のみです。)
POINT!!
・化学変化とは原子の組み合わせが変わり、性質の異なる物質ができること。
・化学変化では「何と何が反応してどのような物質ができるのか」を必ず覚える。
・鉄と硫黄の反応は発熱反応。
・鉄は塩酸と反応して水素を発生するが、硫化鉄は塩酸と反応して硫化水素を発生する。
・このような鉄と硫化鉄での性質のちがいを覚えておくこと。


コメント(承認された場合のみ表示されます)