このページでは「還元とはどのような反応か?」「酸化銅の還元」を中心に解説しています。
動画による解説は↓↓
チャンネル登録はこちらから↓↓↓
化合について・・・→【化合】←
分解について・・・→【分解】←
酸化について・・・→【酸化と燃焼】←
化学変化の計算については
→【質量保存の法則】← または →【定比例の法則(酸化)】← または →【気体の発生に関する計算】←
化学反応式について・・・→【化学反応式】←
で解説しています。
1.還元
酸化物が酸素を失うこと。
酸化とは逆の反応。
※「還」の漢字間違いに注意!
「還元」とは「元に戻す」意味があります。
スーパーなどでよく見る「お客様還元セール」というのは、お客に感謝の気持ちをお返ししますよということ。
理科では「酸化物を酸化前の状態に戻すこと」。
つまり酸化物から酸素が失われる反応のことです。
ただし、酸化物が酸素を失って、その酸素をもらってくれる物質が必要です。
以下にその例を見てみましょう。
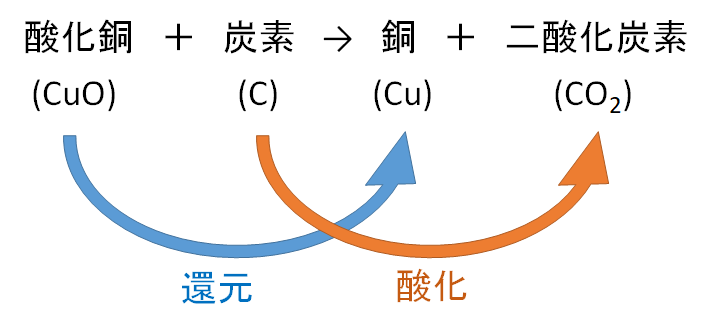
(例1)酸化銅の炭素による還元
(反応の様子) 酸化銅 + 炭素 → 銅 + 二酸化炭素
この反応では、酸化銅は銅になりました。
酸化銅が受けたのは還元という化学変化です。
一方で酸化銅が失った酸素はどこへ行ったのか、というと。
この失われた酸素を炭素がもらいます。そして二酸化炭素になりました。
炭素は二酸化炭素へと変化したのです。
炭素が受けたのは酸化という化学変化です。
このように還元が起こるときには酸化が同時に起こっています。
(例2)酸化銅の水素による還元
(反応の様子) 酸化銅 + 水素 → 銅 + 水
この反応では、酸化銅は銅になりました。
酸化銅が受けたのは還元という化学変化です。
一方で酸化銅が失った酸素はどこへ行ったかというと。
その酸素を水素がもらいました。そして水へと変化しました。
水素は水へと変化したのです。
水素が受けたのは酸化という化学変化です。
やはり還元が起こるときには酸化が同時に起こっています。
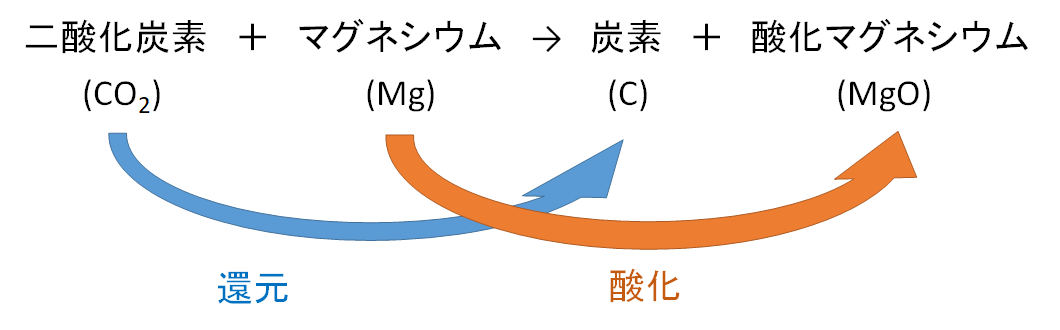
(例3)*二酸化炭素のマグネシウムによる還元
(反応の様子) 二酸化炭素 + マグネシウム → 炭素 + 酸化マグネシウム
この反応では、二酸化炭素が酸素を失って、炭素になりました。
二酸化炭素が受けたのは還元という化学変化です。
一方で二酸化炭素が失った酸素はどこへ行ったかというと。
その酸素をマグネシウムがもらうのです。
そしてマグネシウムと酸素が結びつき、酸化マグネシウムになりました。
ここでマグネシウムが受けたのは酸化という化学変化です。
ここでも還元が起こるときには酸化が同時に起こっています。
POINT!!
・還元の反応では、酸素を受け取ってもらう物質が必要。
・還元が起こっているとき、同時に酸化も起こっている!
2.酸素との結びつきやすさ
酸化銅 + 炭素 → 銅 + 二酸化炭素 の反応で・・・
先ほども登場した、還元の代表的な反応です。
この反応で、酸化銅は、炭素によって酸素を奪われた、ということができます。
つまり銅と炭素を比べたとき、酸素と結びつきやすい順番があって、炭素>銅という順番なのです。
(炭素の方が酸素と結びつきやすい)
二酸化炭素 + マグネシウム → 炭素 + 酸化マグネシウム の反応では・・・
こちらの化学変化では、どうでしょうか。
二酸化炭素は還元されて、炭素になっています。
つまり二酸化炭素は、マグネシウムに酸素を奪われた、ということができます。
よって炭素とマグネシウムを比べたとき、酸素と結びつきやすい順番がやっぱりあるのです。
その順番はマグネシウム>炭素です。
(マグネシウムの方が酸素と結びつきやすい)
この2つをまとめると・・・
この2つの反応から、銅・炭素・マグネシウムの3つの「酸素と結びつきやすい順番」を考えると・・・
マグネシウム>炭素>銅
という順番ということになります。
必ず覚えなければならないものでもないですが、余裕があれば覚えておきましょう。
3.還元の利用
私たちの日常生活に欠かせない”鉄”。
自然界では酸化鉄の形で存在します。
自然にある、酸化鉄を含む鉱物を鉄鉱石といいます。
現実の世界では、鉄を取り出したいときは、鉄鉱石を利用します。
とくに鉄鉱石の中でも、酸化鉄の多い赤鉄鉱や磁鉄鉱を利用します。
これらの鉄鉱石にコークス(炭素)を混ぜ合わせ加熱し、酸化鉄を還元して鉄を取り出しています。
しかし、この取り出した鉄の中には炭素が多く混じってしまいます。
(純粋な鉄ではない)
そのため、酸素を吹きこみ、炭素を酸化して二酸化炭素にしてしまいます。
こうすることで不純物である炭素を取り除きます。
このように鉄鉱石とコークスによって還元の反応を利用して鉄がつくられています。
より詳しくは→【鉄の精錬】←で。

コメント(承認された場合のみ表示されます)