このページでは「原子1個の質量」に関する問題の考え方を解説しています。
中学校ではあまり学習しない発展的な内容です。(教科書内容を超える)
化学反応式について・・・・→【化学反応式】←
質量保存の法則について・・→【質量保存の法則】←
定比例の法則について・・・→【定比例の法則(酸化)】←
を理解しておきましょう。
1.原子1個の質量を考える問題
原子●個や分子●個あたり、を考える問題は
①化学反応式を書く
②モデル図になおす
③質量を考える
という手順で考えましょう。
(例1)水素の燃焼
例えば ”水素が燃焼して水になる” という反応についてみてみましょう。
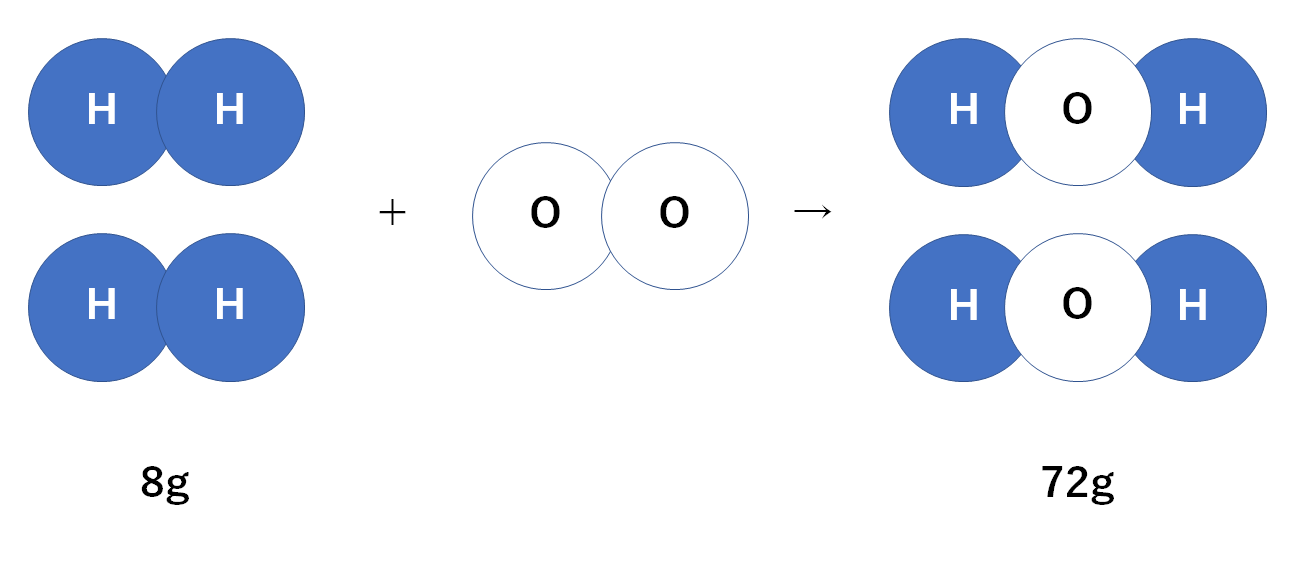
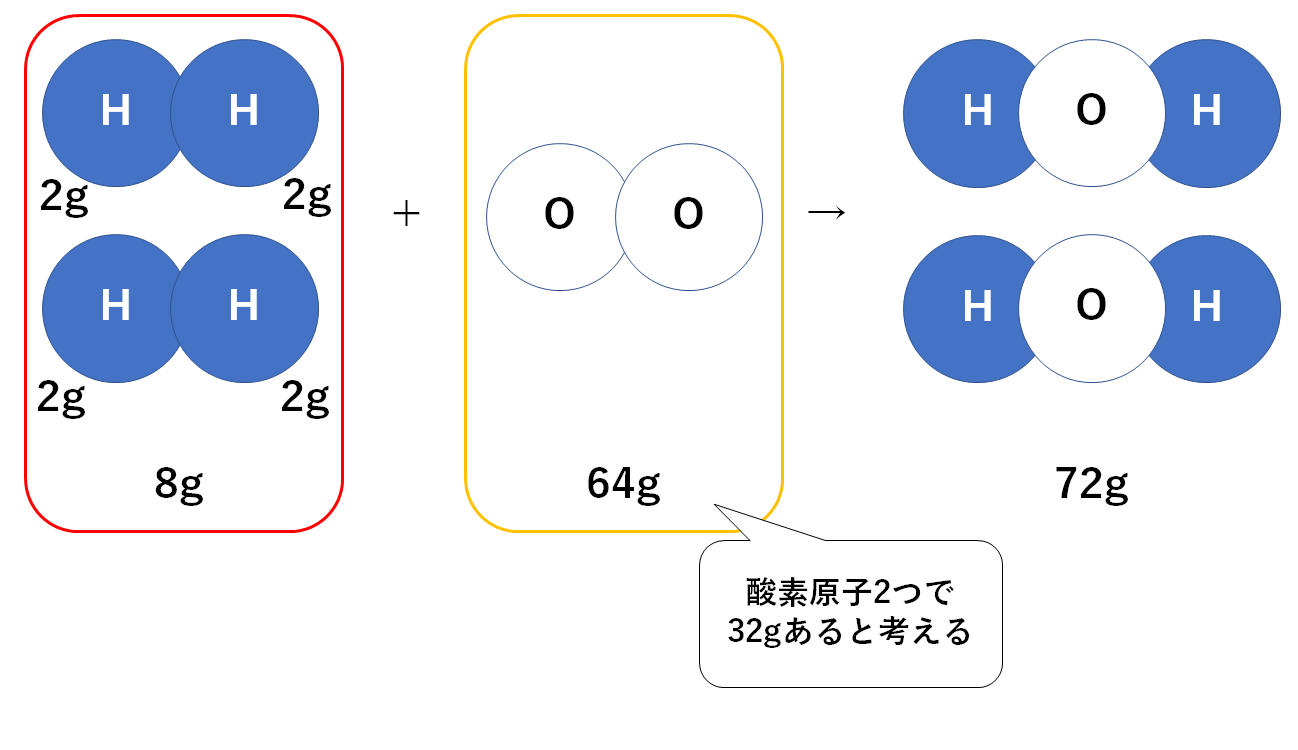
水素8gを完全に燃焼させると水72gが生じます。
この数値から水素原子1個の質量と酸素原子1個の質量の比を考えましょう。
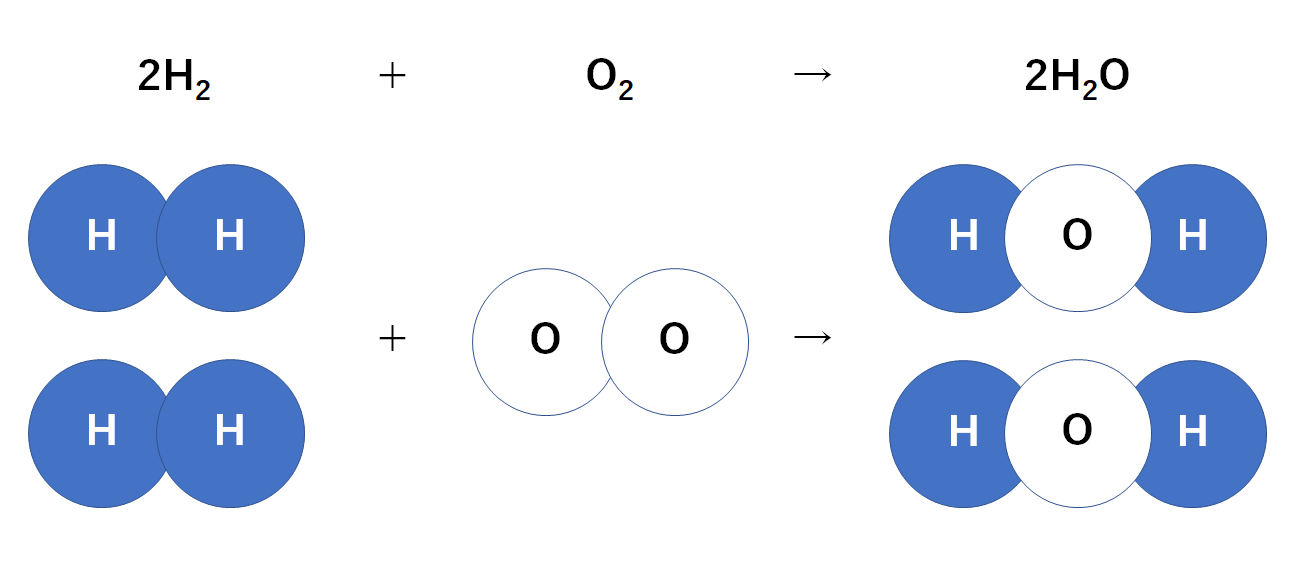
このときこの反応を化学反応式で表すと
2H2 + O2 → 2H2O
です。
これをモデル図に表しましょう。(↓の図)
モデル図に「水素8g・水72g」の情報を追加しましょう。(↓の図)
今のままでは、反応した酸素がわかりません。
ここで質量保存の法則を利用します。
質量保存の法則とは・・・
化学変化の前後で質量の総和は変わらない。
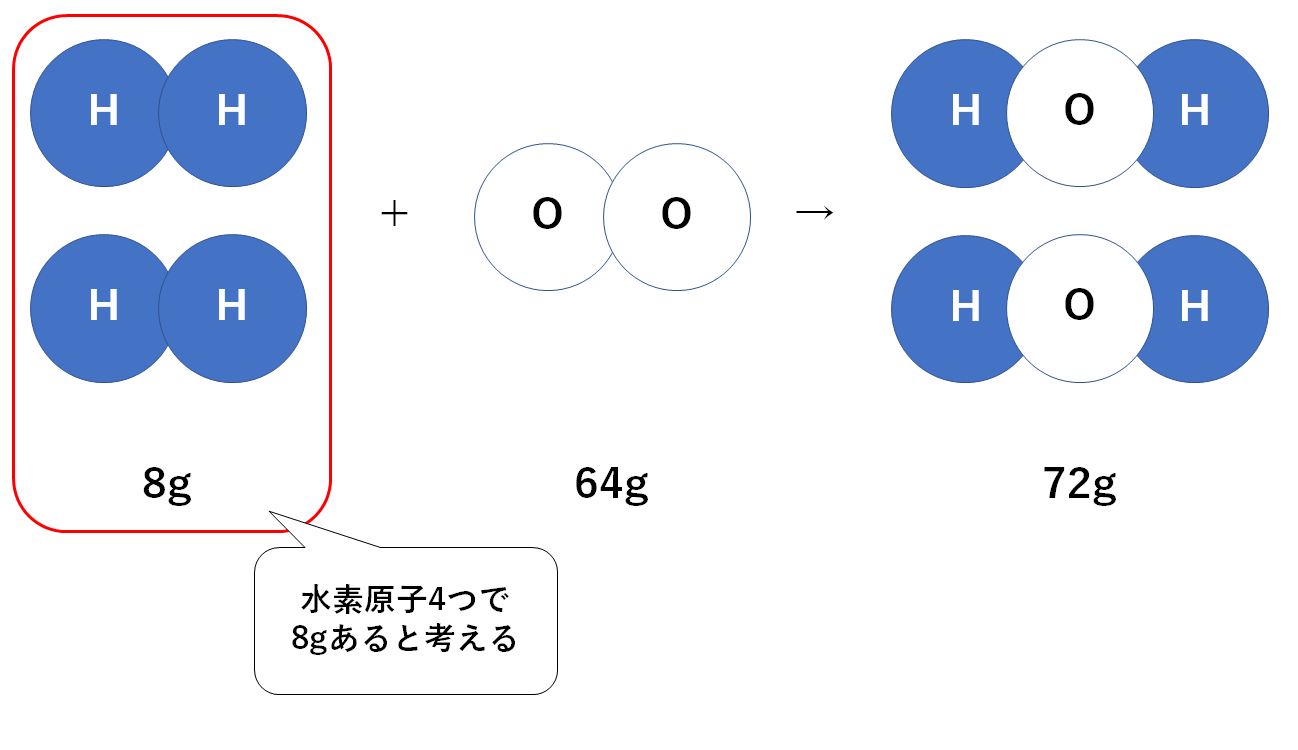
反応した酸素は64gであるとわかります。(↓の図)
では、ここで水素原子1個の質量と酸素原子1個の質量を考えましょう。
このモデル図と質量を見てみます。
まずは水素から。
左辺には水素原子が4つあります。
水素原子が4つで8gと考えます。(↓の図)
つまり水素原子1個で2gです。
今度は酸素に目を移しましょう。
左辺には酸素原子が2つあります。
酸素原子が2つで64gと考えます。(↓の図)
つまり酸素原子1個で32gです。
よって
$$水素原子1個:酸素原子1個=2:32=1:16$$
となります。
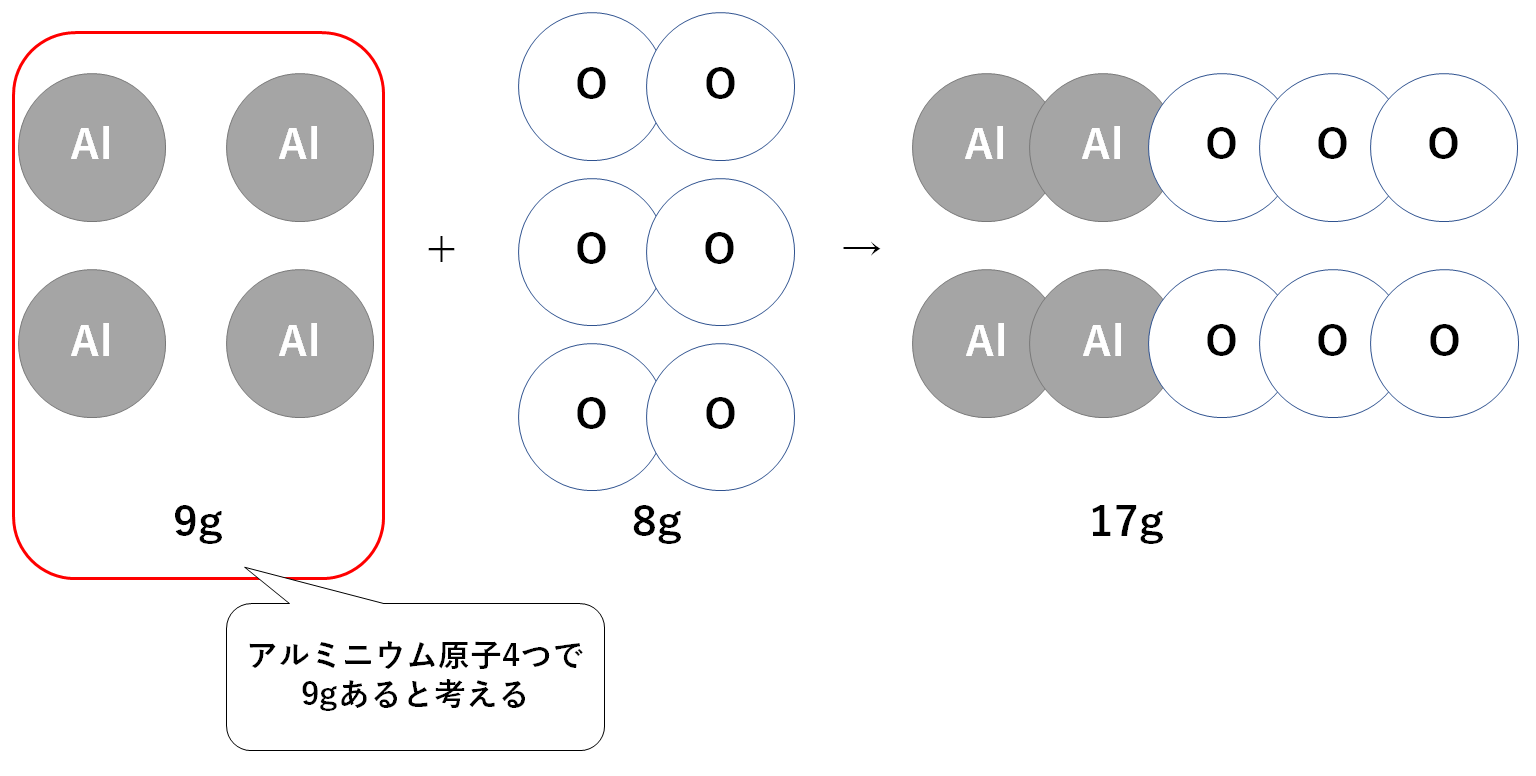
(例2)アルミニウムの酸化
つづいてはアルミニウムAlが酸化して酸化アルミニウムAl2O3になる反応を考えます。
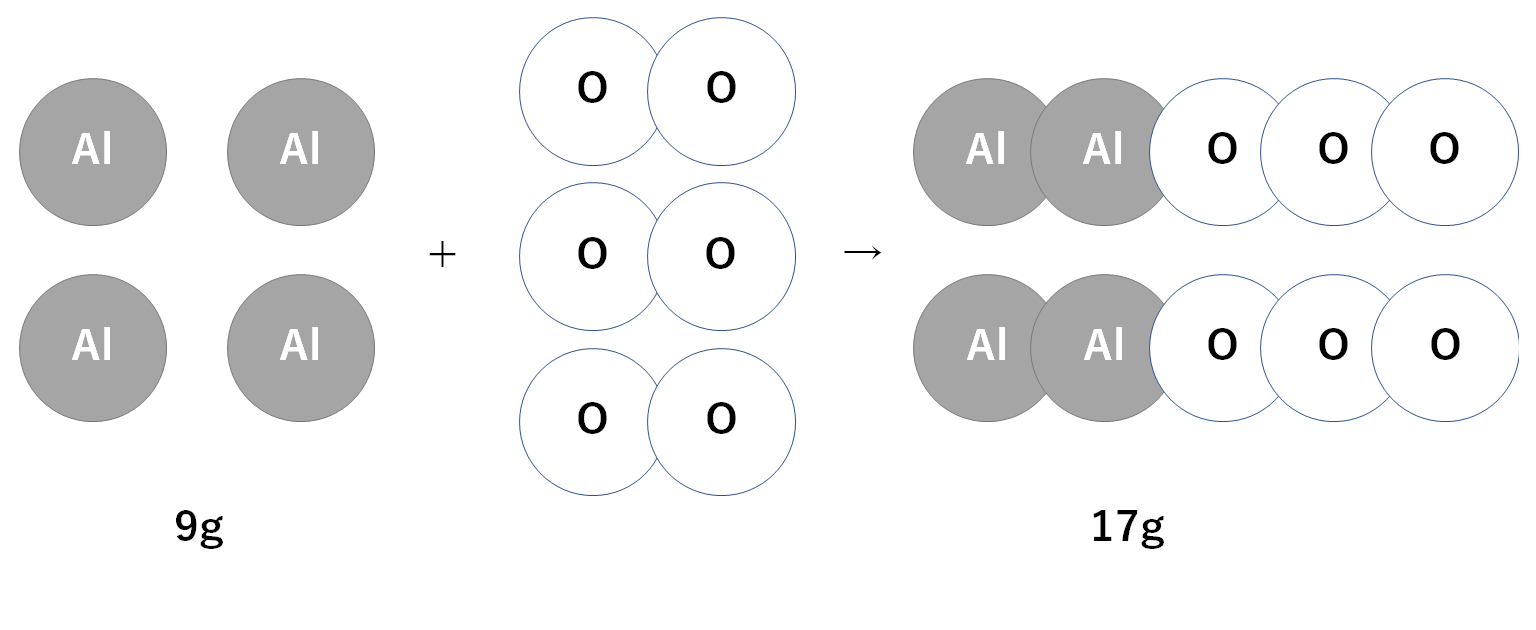
アルミニウム9gを完全に酸化すると酸化アルミニウムが17g生じます。
このとき、この反応を化学反応式で表すと
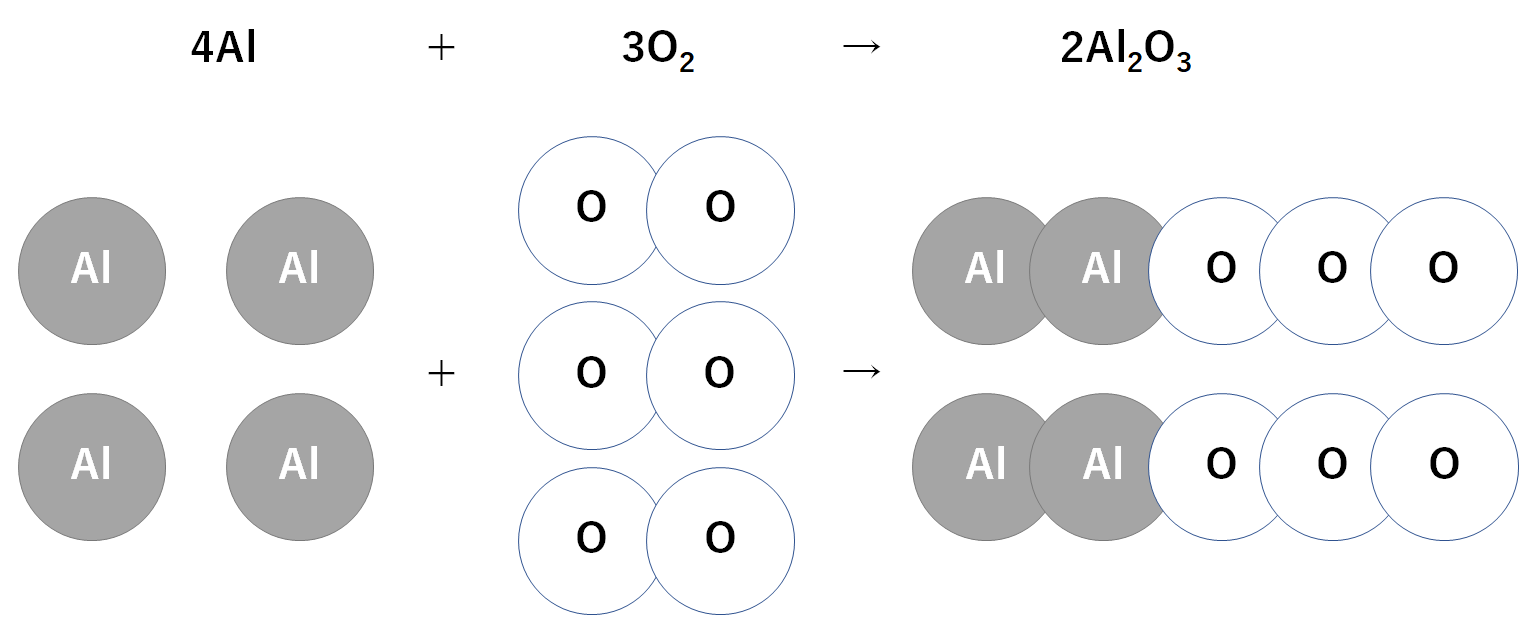
4Al + 3O2 → 2Al2O3
です。
これをモデル図に表しましょう。(↓の図)
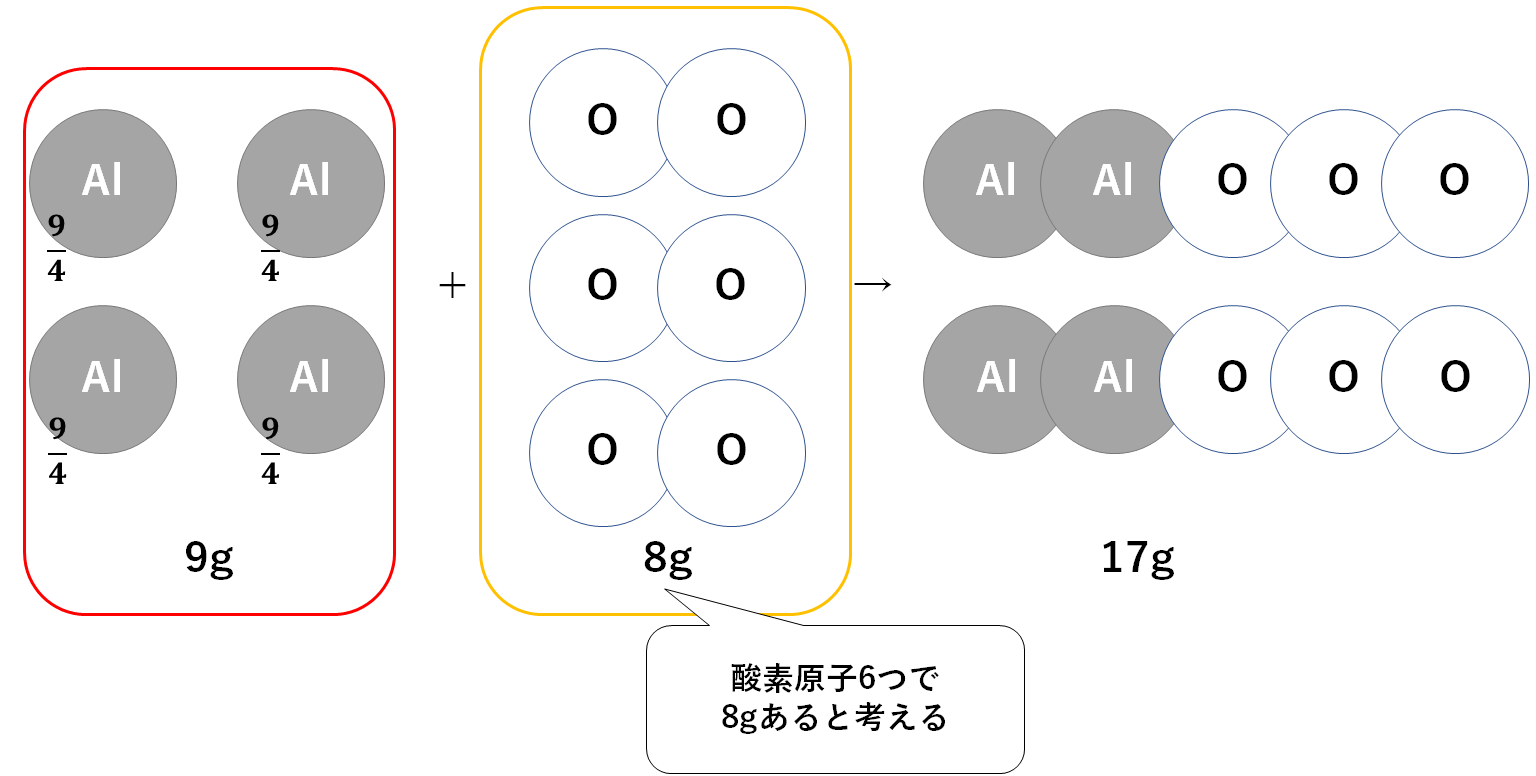
モデル図に「アルミニウム9g・酸化アルミニウム17g」の情報を追加します。(↓の図)
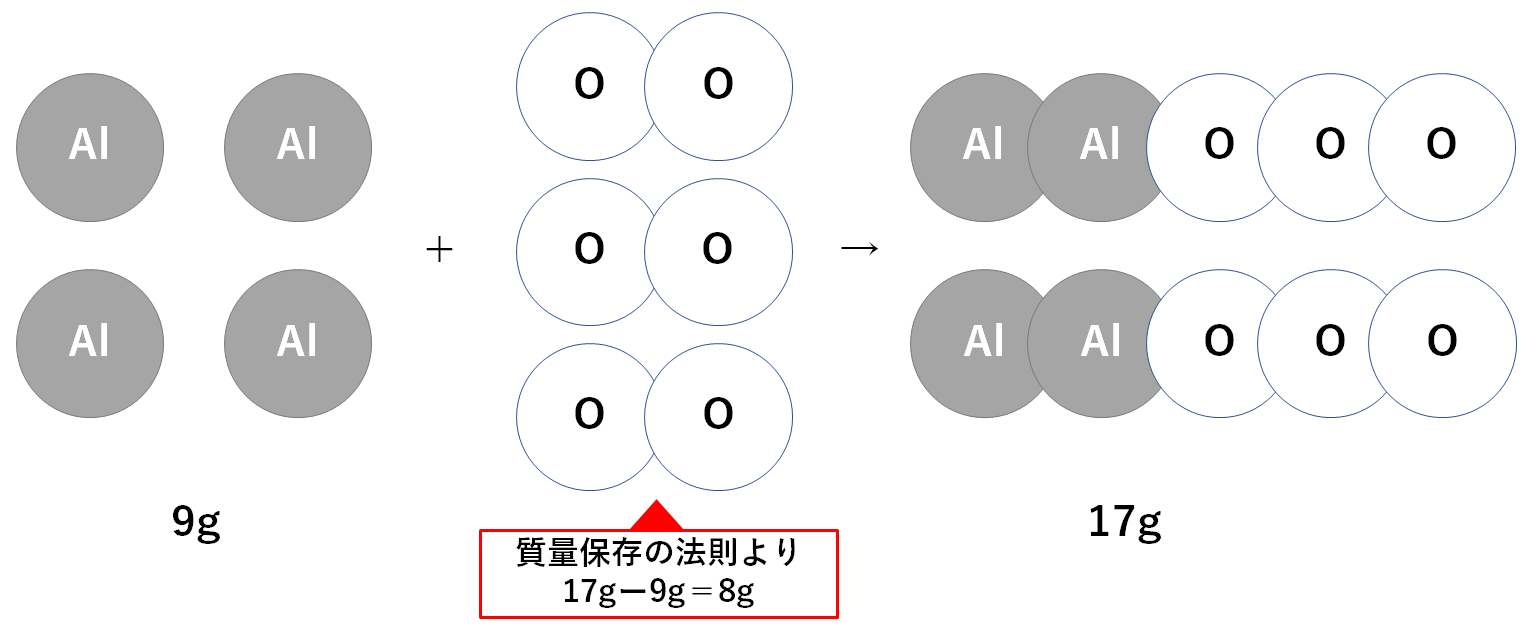
先ほどと同じく質量保存の法則を利用して、反応した酸素を求めておきましょう。
反応した酸素は8gであるとわかります。(↓の図)
では、ここでアルミニウム原子1個の質量と酸素原子1個の質量を考えましょう。
このモデル図と質量を見てみます。
まずアルミニウムに注目です。
左辺にはアルミニウム原子が4個あります。
アルミニウム原子4個で9gと考えます。(↓の図)
つまりアルミニウム原子1個の質量は
$$\frac{9}{4}g$$
となります。
同様に酸素に注目。
左辺には酸素原子が6個あるので、酸素原子6個で8gと考えます。(↓の図)
よって酸素原子1個の質量は
$$\frac{8}{6}g=\frac{4}{3}g$$
となります。
したがって
$$アルミニウム原子1個:酸素原子1個=\frac{9}{4}:\frac{4}{3}=27:16$$
となります。
POINT!!
原子1個の質量の比を求める問題では・・・
① 化学反応式を書く。
② モデル図になおす。
③ 質量を書き込む。
→ 原子1個の質量を求めていく。
2.反応する質量比を考える問題
原子1個あたりにも質量があり、もちろん現実に測定されています。
同じ種類の原子は同じ質量をもち、その種類ごとに質量は異なります。
例えば炭素原子の質量は、1.9944235 × 10-23(g)です。(めちゃめちゃ軽い)
こんな数字を使って計算はやりにくいので、先ほどのような原子1個の質量比を利用します。
例えば銅原子・酸素原子・炭素原子・水素原子の1個あたりの質量比は
$$銅原子:酸素原子:炭素原子:水素原子=64:16:12:1$$
です。
これを利用すれば、どのような比で物質が反応するかもわかります。
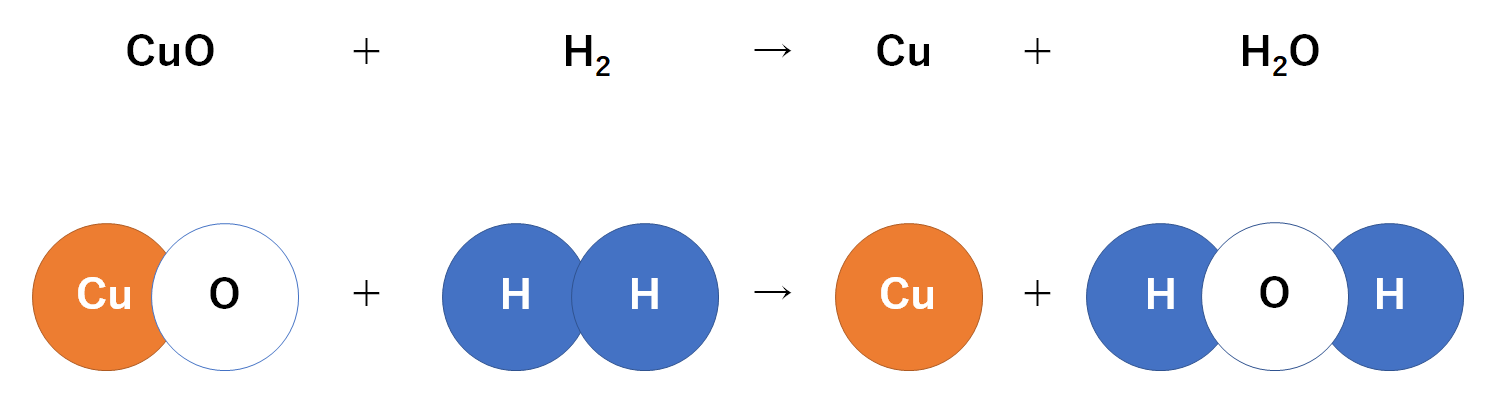
例えば酸化銅の水素による還元。
化学反応式で書くと
CuO + H2 → Cu + H2O
です。
これをモデル図に書き換えましょう。(↓の図)
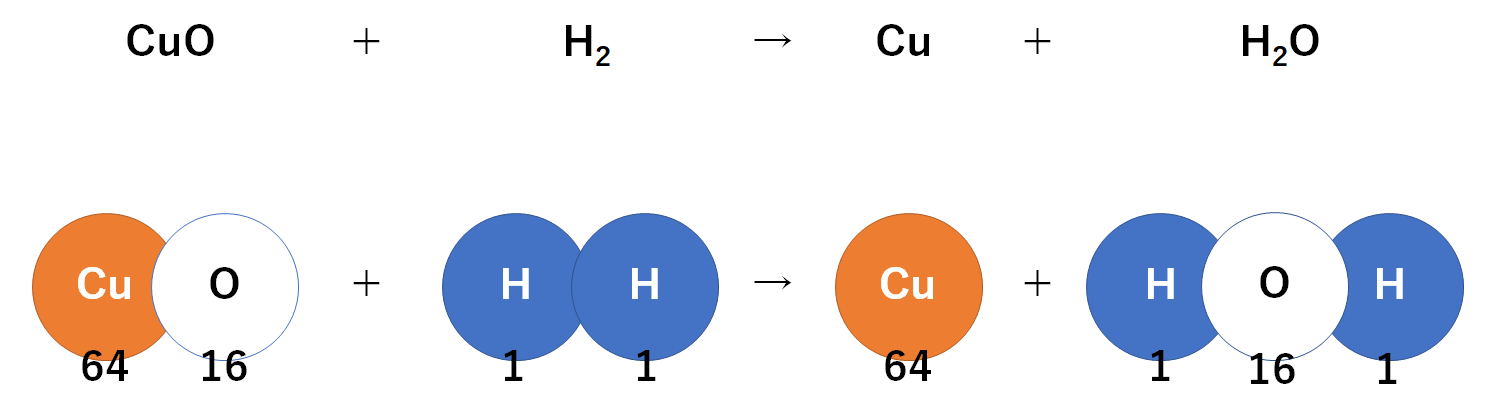
ここで先ほどの比を利用して
銅原子1個を64g・酸素原子1個を16g・炭素原子1個を12g・水素原子1個を1g
と仮に考えます。
これをモデル図に書き込みましょう。(↓の図)
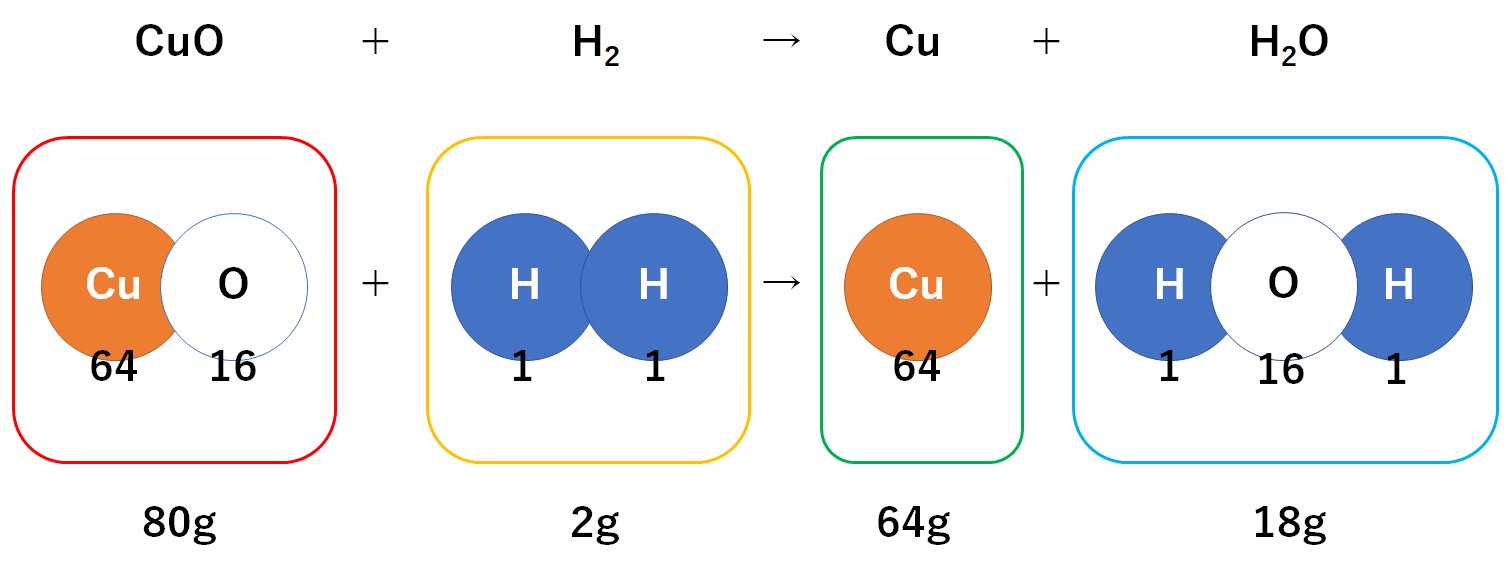
その質量を物質ごとに足してみます。
例えばCuOは
Cu・・・64g O・・・16g
なので
CuO・・・80g
と表せます。
ほかの物質も同様に計算すると↓のようになります。
よって
CuO:H2:Cu:H2O=80:2:64:18
の比で反応することになります。
(もちろん質量保存の法則も成り立っていますね。)
このように比が求まれば計算ができるようになります。
「16gの酸化銅を還元するのに必要な水素は?」
と聞かれても、
求める水素をx(g)として
$$80:2=16:x$$
$$x=0.4$$
となり0.4gと求められます。
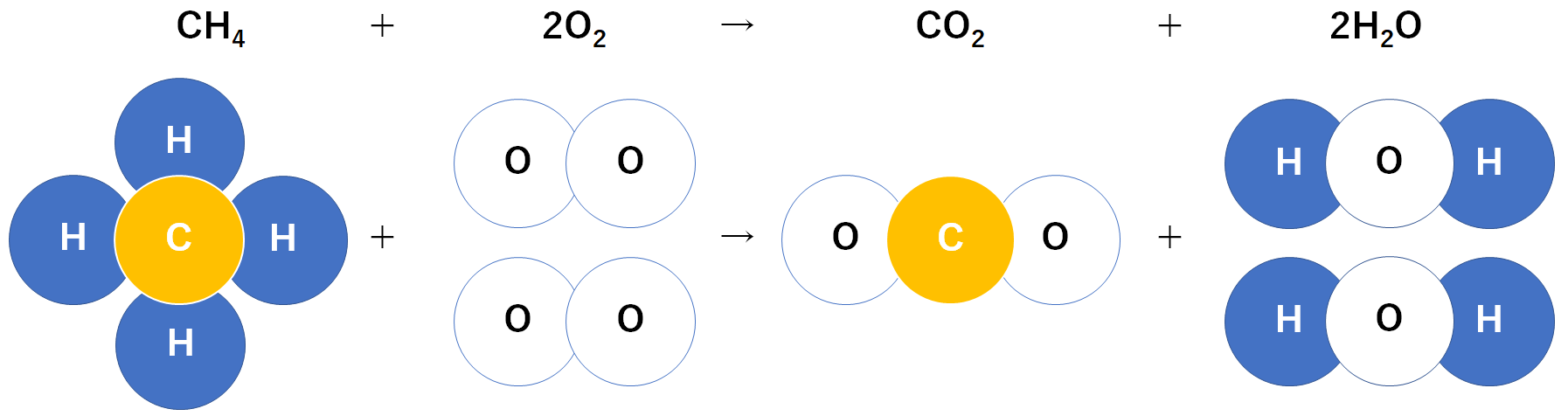
(例3)メタンの燃焼
では次の反応で表される「メタンの燃焼」の質量比を考えてみましょう。
CH4 + 2O2 → CO2 + 2H2O
※CH4がメタンを表す化学式です。
これをモデル図に直します。(↓の図)
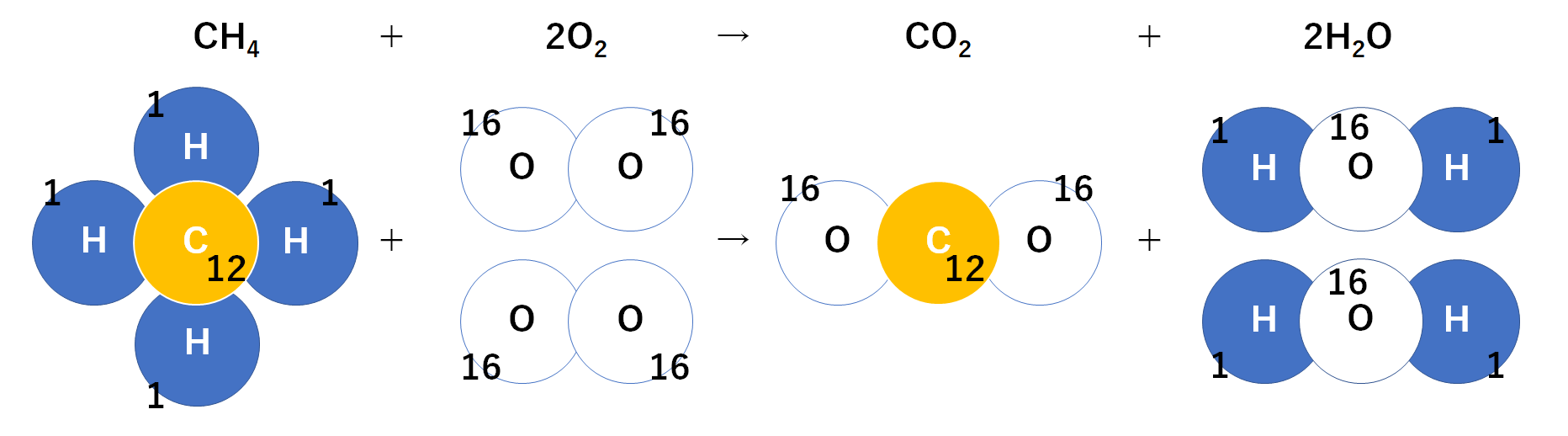
先ほどの比を利用して
銅原子1個を64g・酸素原子1個を16g・炭素原子1個を12g・水素原子1個を1g
と仮に考えます。
これをモデル図に書き込みましょう。(↓の図)
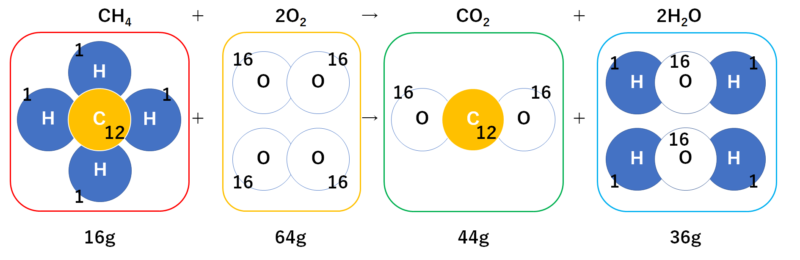
その質量を物質ごとに足してみます。(↓の図)
よって
CH4:O2:CO2:H2O=16:64:44:36
の比で反応することになります。
(質量保存の法則が成り立っていることも確認しておきましょう。)
POINT!!
原子1個の質量比を利用すれば、化学変化における反応の質量比もわかる。
① 化学反応式を書く
② モデル図に直す
③ モデル1つ1つに原子1個の質量を書き込む
→ 反応する物質の質量を求めていく。
3.原子量
先述の通り、原子1個の質量は測定されています。
原子1個の質量は非常に小さいので、化学では炭素原子1個の質量を12として、ほかの原子の質
量を表しています。(相対質量という)
この炭素原子を基準とした相対質量を原子量といいます。
余裕があれば覚えてしまってもよいかもしれません。
≪主な原子量≫
C原子1個の質量を12としたとき
H:1 N:14 O:16 Na:23 Mg:24 Al:27 Cl:35.5 Cu:64
※実際には少し誤差があるので過信は禁物。大学入試では必ず与えられる。
POINT!!
原子1個の質量に関する問題では
・化学反応式を書く
・モデル図に直す
・モデル図に質量あてはめながら考える
の3ステップで考えよう。


コメント(承認された場合のみ表示されます)