このページでは「イオンとは何なのか」「覚えるべきイオンの化学式とは」について解説しています。
動画での解説は↓↓
チャンネル登録はこちらから↓↓↓
1.原子の構造
原子は↓のような構造をしています。
中心には原子核があり、その中に陽子・中性子があります。
原子核のまわりを電子がまわっています。
以上をまとめておきます。
・陽子 ・・・+の電気を帯びた粒。
・中性子・・・+でも-でもない(電気を帯びていない)粒。
・原子核・・・なかに陽子があるので+の電気を帯びている。
・電子 ・・・-の電気を帯びた粒。
※陽子の数によって原子の種類が異なる。
原子では必ず「陽子の数=電子の数」が成り立っています。
これを電気的に中性であるといいます。
POINT!!
原子では必ず
「陽子(+)の数=電子の数(-)」
となっており、
全体として + でも - でもない。
※同位体
同じ水素原子でも、
・中性子が0個のもの(軽水素)
・中性子が1個のもの(重水素)
・中性子が2個のもの(三重水素)
などがあります。
このように中性子の個数だけが異なる原子を同位体といいます。
同位体は化学的な性質は似通っていますが、質量(物理的性質)が異なります。
2.イオン
原子が電子を得たり、失ったりして電気を帯びたもの。
原子が電子を得たり、失ったりすると
「陽子の数(+)=電子の数(-)」となっていたバランスが崩れます。
このように、原子が + や - にバランスを崩してしまったものをイオンといいます。
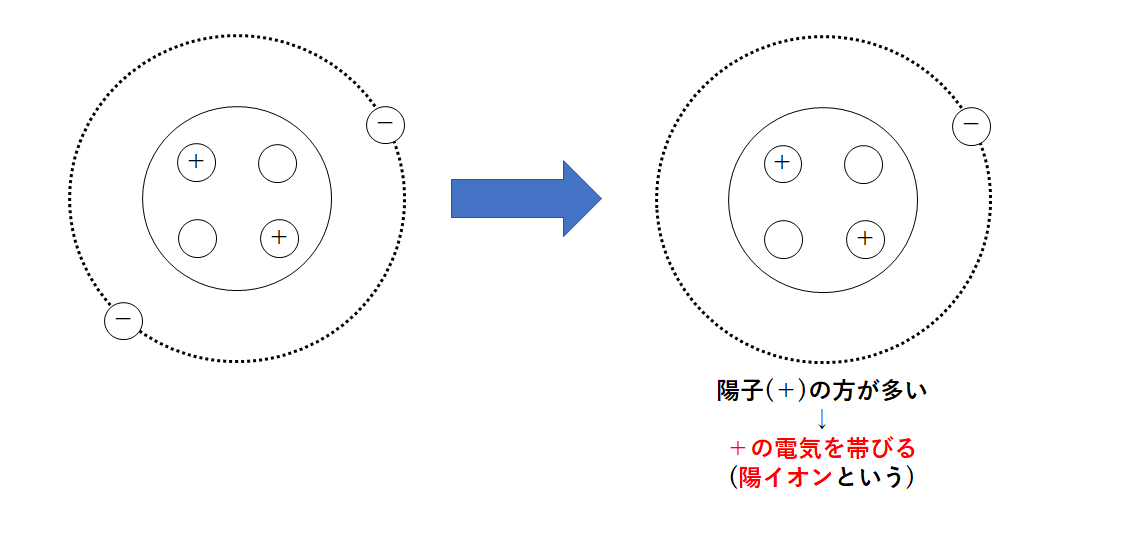
原子が電子を失った場合
原子では「陽子の数=電子の数」が成り立っています。
原子が電子を1つ失ったとしましょう。
すると陽子の数(+)>電子の数(-)となります。
よって+にかたよります。
つまり電子を失うと+の電気を帯びることになります。
このように+の電気を帯びた粒を陽イオンといいます。
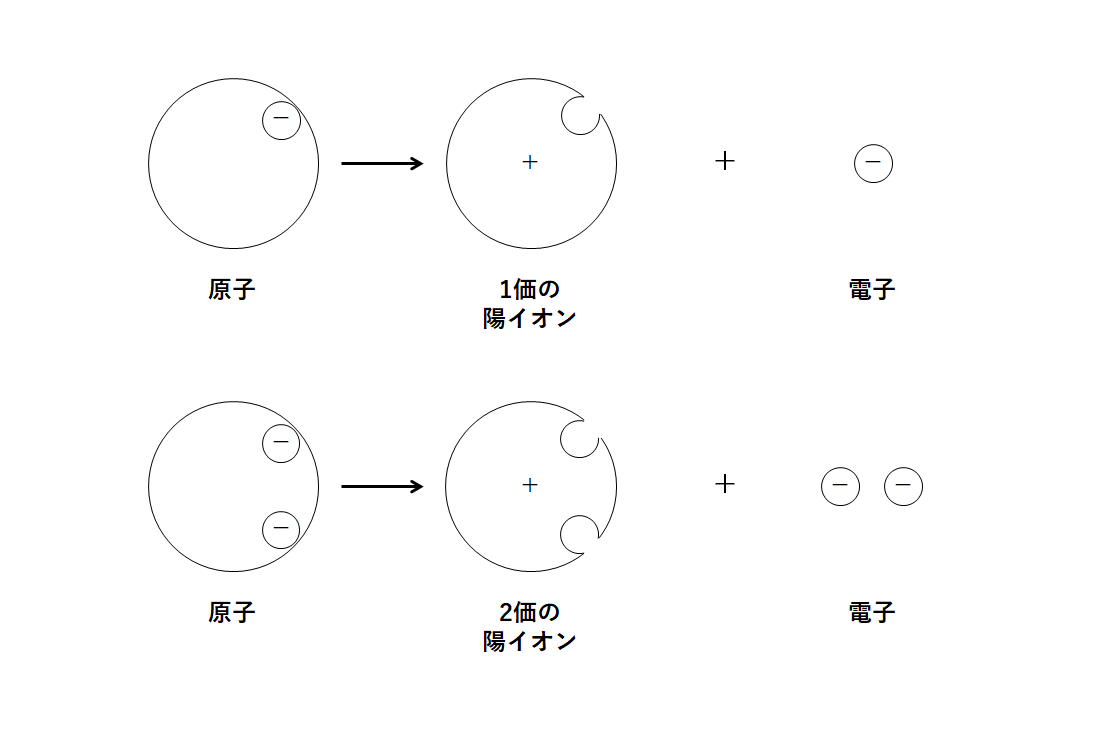
電子を1つ失う
→ 1つ分の+の電気を帯びる
→ これを「1価の陽イオン」と呼びます。
電子を2つ失う
→ 2つ分の+の電気を帯びる
→ これを「2価の陽イオン」といいます。
↓の図は陽イオンのできかたのモデル図です。
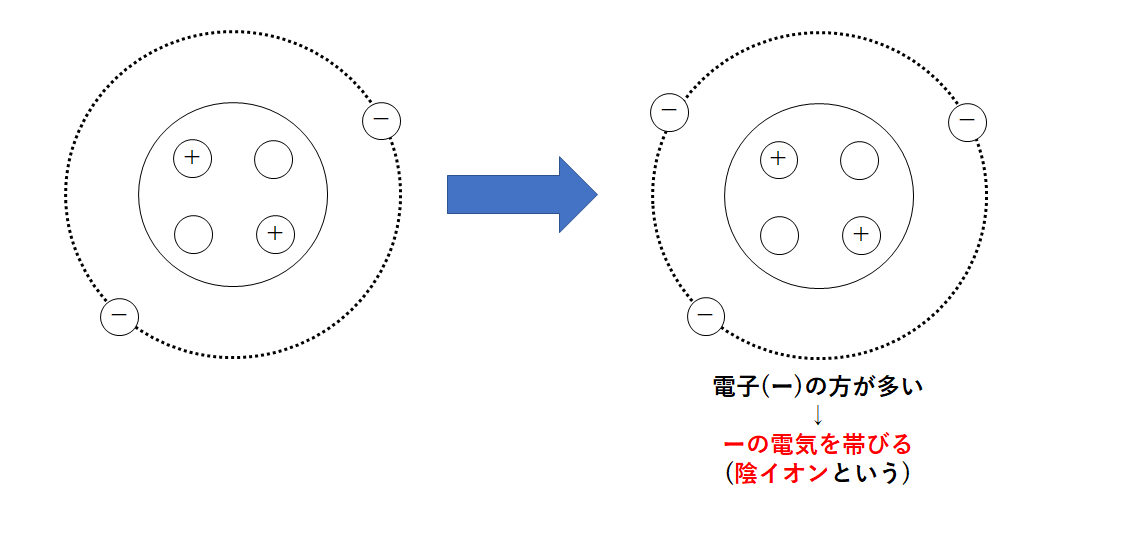
原子が電子を得た場合
原子が電子を1つ得たとしましょう。
すると陽子の数(+)<電子の数(-)となります。
-にかたよってしまいます。
すなわち、電子を得ると-の電気を帯びることになるのです。
このように-の電気を帯びた粒を陰イオンといいます。
電子を1つ得る
→ 1つ分の-の電気を帯びる
→ このイオンを「1価の陰イオン」と呼びます。
電子を2つ得る
→ 2つ分の-の電気を帯びる
→ このイオンを「2価の陰イオン」といいます。
↓の図は陰イオンのできかたのモデル図です。
原子が電子を失ってできる。+の電気を帯びたもの。
■陰イオン
原子が電子を得てできる。-の電気を帯びたもの。
どれだけ電子を得たか。あるいは失ったか。
例)アルミニウムイオンは3価の陽イオンである、という文章は・・・
「アルミニウムイオン」は「アルミニウム原子」が電子を3個失ってできたイオン。
3個分の+の電気を帯びている、ということです。
3.イオンを表す化学式
どの原子が「▲個の電子を失って○価の陽イオン」になるのか、
どの原子が「◆個の電子を得て△価の陰イオン」になるのかは決まっています。
例えば「銅原子」は「電子を2個失って2価の陽イオンになる」と決まっています。
このイオンを銅イオンと呼ぶわけです。
イオンを表すには、元素記号に手を加えます。
例)銅原子の元素記号は Cu → 銅イオンは Cu2+ と表す。
右上の「2」が価数を表します。
そのうしろに「+」がついているので陽イオンであることを表します。
イオンを表すときは、元素記号の右上に「価数」と「+または-」をつけます。
このようにしてイオンを表した記号を、イオンを表す化学式といいます。
※中には複数の原子が集まってイオンになるものもあります。
※むかしは「イオン式」という言い方もありましたが、2021年の教科書改訂より「化学式」の言葉に統一されました。
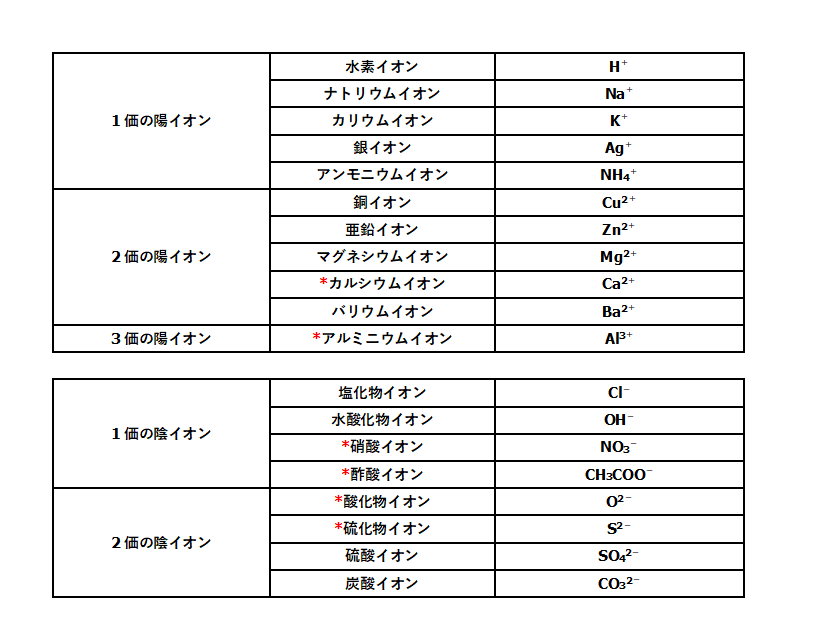
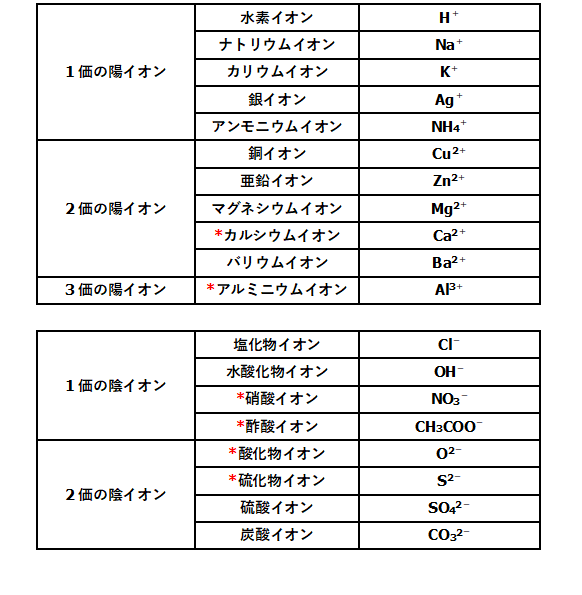
主なイオンを表す化学式
まずは元素記号を覚えておくこと。
その上で、右上に何を付け足すのかを覚えましょう。
*の印がついているものはあまりテストに出ません。
必要があれば覚えましょう。
POINT!!
・陽イオンは「原子が電子を失った」もの。
・陰イオンは「原子が電子を得た」もの。
・イオンを表す化学式を覚えよう。



コメント(承認された場合のみ表示されます)
電子には種類はあるんですか
nakaharu様
コメントありがとうございます。
電子は原子中の位置によって「最外殻電子」と呼んだりすることもありますが、基本的にはどれも同じです。
ありがとうございます。 役に立ちました。
わかりやすい解説ありがとうございます
Well様
コメントありがとうございます。
お役に立てたならば幸いです。
また是非ご活用くださいね。
水素イオンはH+と表すのに対して、アンモニウムイオンはNH₄+と表しますよね。水素も分子なのに、なぜH₂+と表さないんですか?
わくせい様
返信が遅くなり大変申し訳ございません。
水素イオンはもともと水素原子で、その水素原子が電子を1つ失ったできたものです。
アンモニウムイオンはもともと窒素原子1つと水素原子4つの集まりで、この集団が電子を1つ失ったものです。
原子、または複数の原子がイオンになったという考え方です。
とてもわかりやすかったです!
私は、イオンと原子、分子などがごちゃごちゃになってしまいます。
どうすればごちゃごちゃにならずにすみますか?
よろしければ教えていただきたいです。
よろしくおねがいしますm(_ _)m
のん様
コメントありがとうございます。
イオン→電気を帯びている
原子→全体としては電気を帯びていない
分子→原子が集まったもの、全体としては電気を帯びていない
まず、この違いをしっかりと認識しておくことが大切かと思います。
化学式がなかなか覚える事ができないんですけどなにかコツはあったりしませんか?
恋音様
コメントありがとうございます。
そして返信が遅くなり大変申し訳ありません。
「酸化~」とつくもの→「~O」
「炭酸~」とつくもの→「~CO3」
「水酸化~」とつくもの→「~OH」または「~(OH)2」
などある程度の規則性はあります。
それをうまく活用するのがよいかと思います。
このサイトを見てとても理解が深まりました。
これからもこのサイトを使ってどんどん理解したいと思います。
とりあえずテストまで頑張ろう
3年3組様
コメントありがとうございます。
ご理解のお役に立てていればうれしい限りです。
またいつでもご活用いただければと思います。
とってもわかりやすかったです‼
IQ117様
コメントありがとうございます。
わかりやすいと言っていただけてとてもうれしいです。
ご理解のお役に立てていれば幸いです。
またぜひご活用ください。