*このページで「水の電気分解のしくみ」をイオンを使った解説をしています。
イオン化傾向という考え方を使っています。
中学校内容よりも少し、一部に発展的な内容を含みます。
※できれば→【イオンとは】←や→【電離・電解質】←も参考に。
※塩酸の電気分解については→【塩酸の電気分解】←を。
※塩化銅水溶液の電気分解については→【塩化銅水溶液の電気分解】←を。
1.水の電気分解
1つの物質が2つ以上の物質に変化する化学変化。
電気を通すことで行う分解。
電気エネルギーを化学エネルギーに変換している。
(反応の様子) 水 → 水素 + 酸素
(化学反応式) 2H2O → 2H2 + O2
2.水の電気分解の仕組み
電源の+極からつながっている電極が陽極。
電源の-極からつながっている電極が陰極。
※電極には他の物質と反応しにくい炭素や白金を用いることが多い。
POINT!!
電気分解は、次のイメージを持っておこう!
→ 溶液に電気を流す。つまり溶液中の電子を動かす。
→ 溶液中のイオンが無理やり電子を受け渡しさせられて、原子にもどる反応のこと!
水は電気を通しにくいため、水酸化ナトリウムを加えて電気を通しやすくします。
または水酸化ナトリウムの代わりに硫酸を加えることもあります。
それぞれで起こる反応が異なるので気を付けましょう。
[Ⅰ] 水酸化ナトリウムを加えた場合
水を容器に入れます。
水はごくわずかしか電離しません。
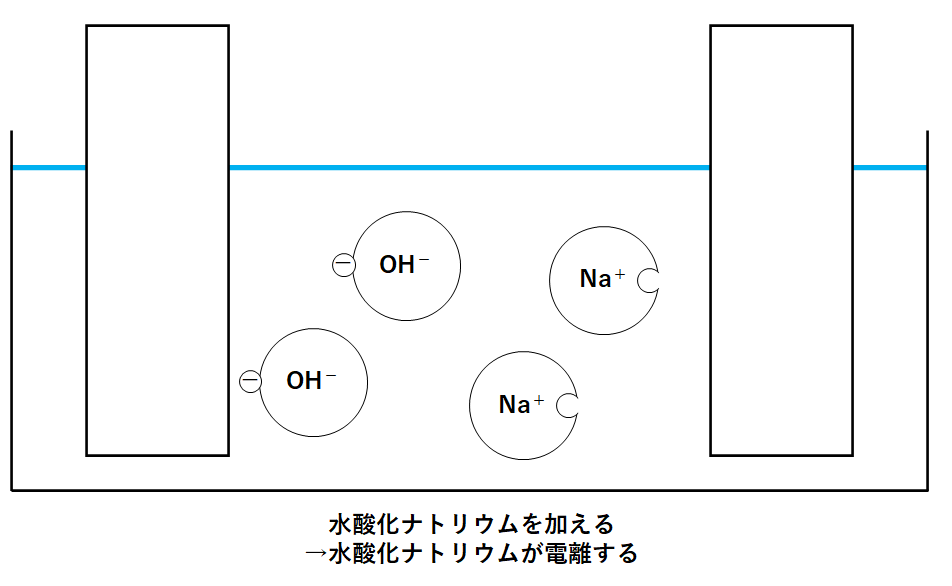
そこで水酸化ナトリウムを加えます。
水酸化ナトリウムは次のように電離します。
電離式: NaOH → Na+ + OH-
よって↓の図のように各イオンが存在します。
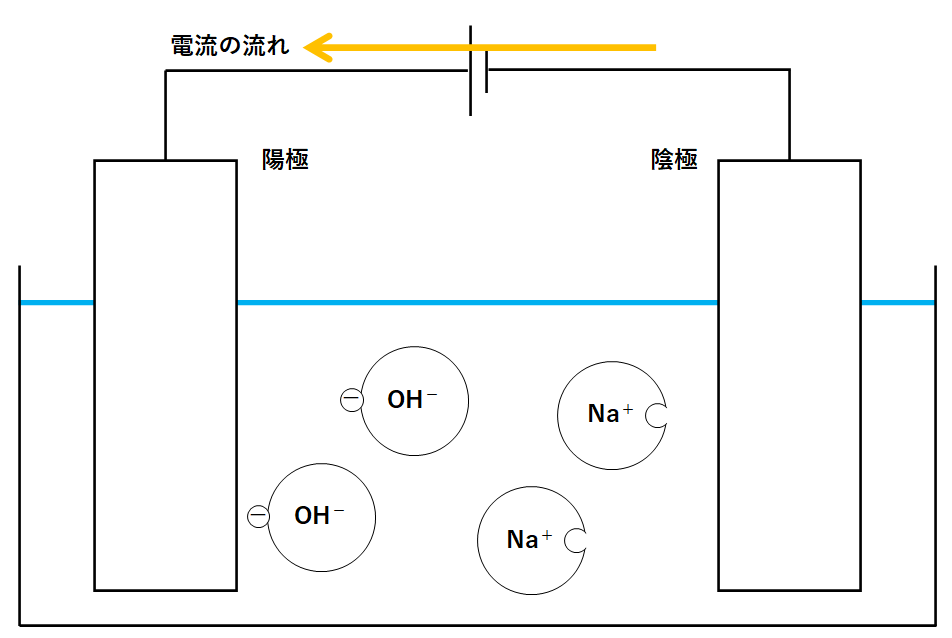
ここに電源装置をつなぎます。
↓のように電流が流れます。
電流の正体は電子の流れです。
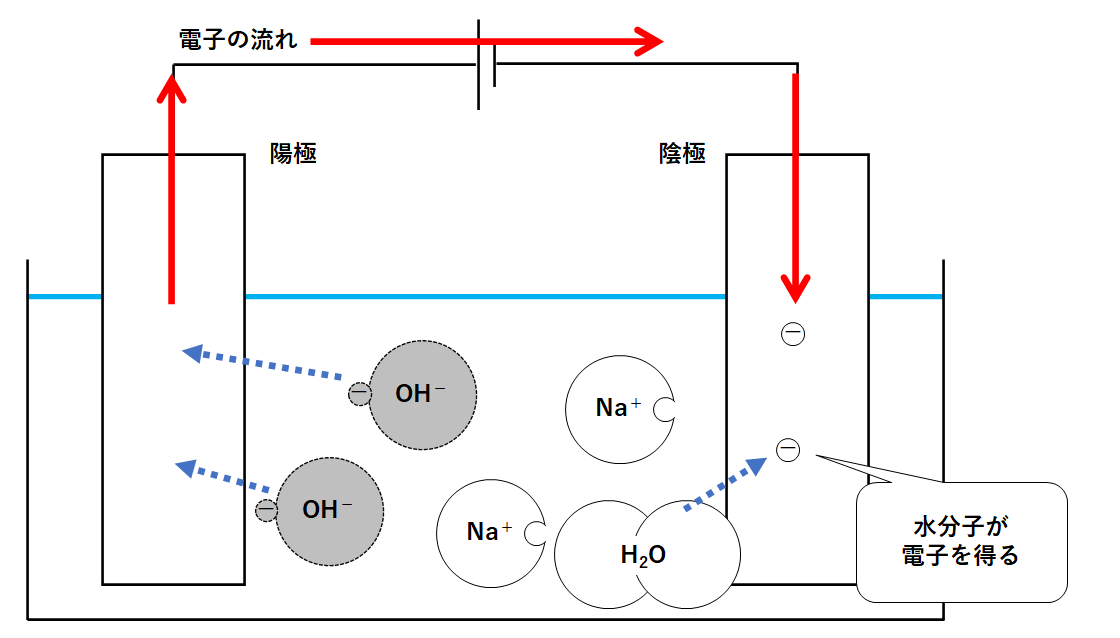
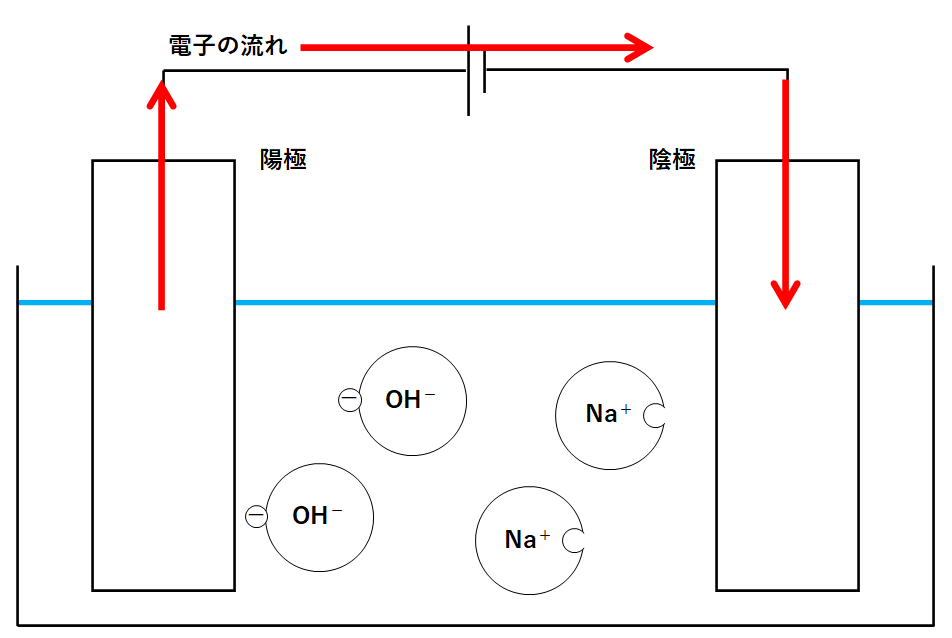
しかし電流の流れは電子の流れと反対向きでした。(↓の図)
電源装置は電子を動かす役目をします。
そのためには陽極で誰かから電子を渡してもらう必要があります。
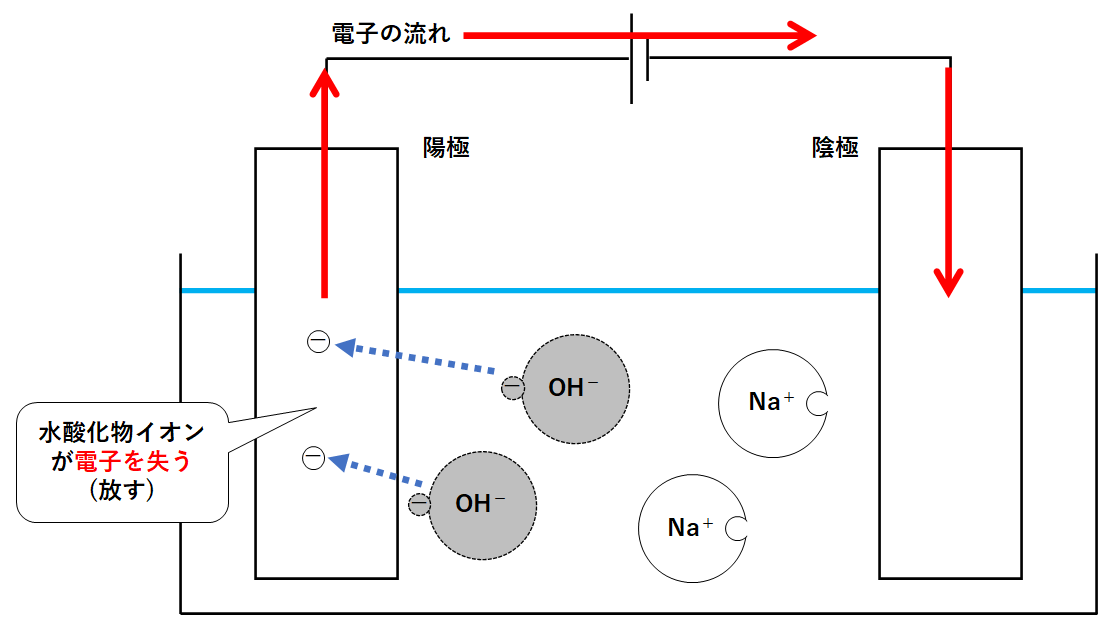
容器内で電子を多く持っているのは陰イオンである水酸化物イオンOH-です。
水酸化物イオンは陽極に近づき電子を失います(陽極に渡す)。(↓の図)
水酸化物イオンは電子を失たものが4つ集まることで酸素と水 になります。(↓の図)
これが以下のように…
このように陽極側では酸素の気体が発生するのです。
この反応を式にすると
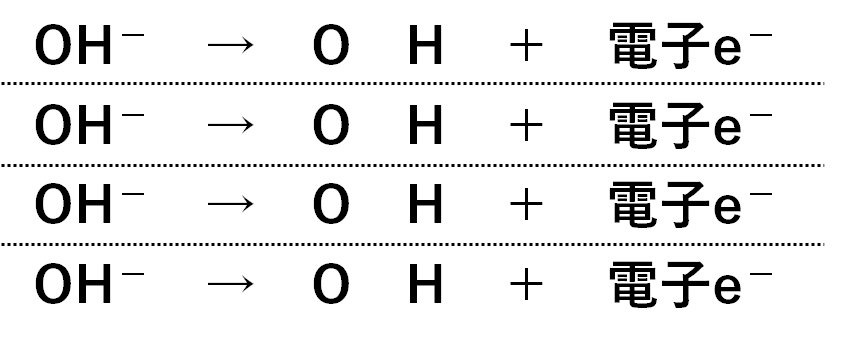
4OH- → O2 + 2H2O + 4e-
となります。
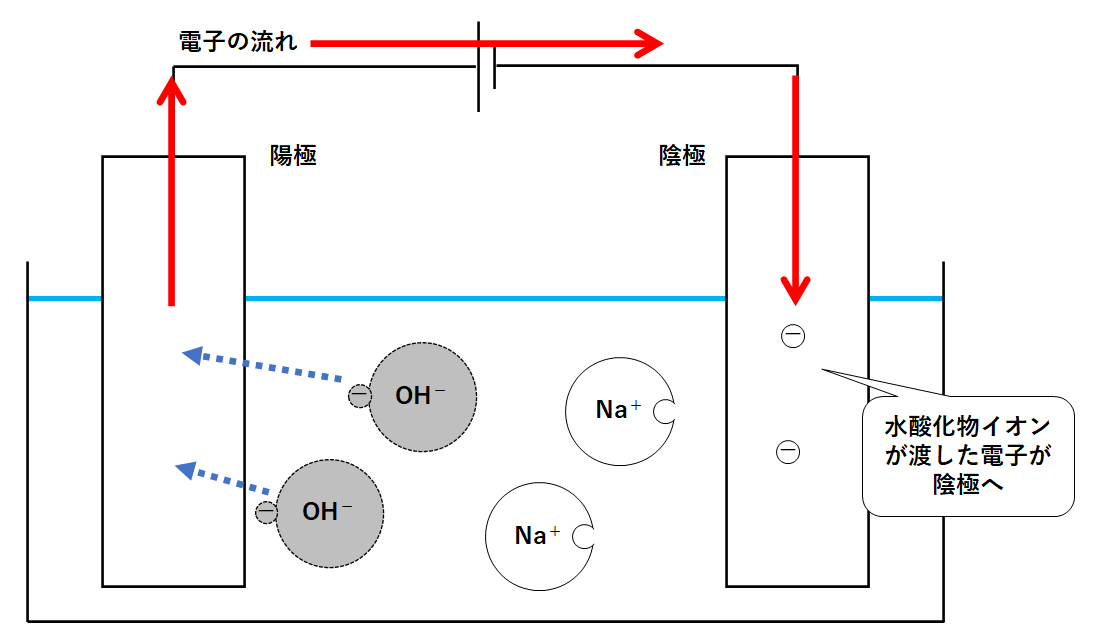
陽極には水酸化物イオンが置いていった電子があります。
この電子は電源装置によって陰極に運ばれます。(↓の図)
放っておくと電子はたまりっぱなしです。
誰かに持って行ってもらう必要があります。
陰極にたまった電子をもらうのは、本来であれば陽イオンです。
容器内にはナトリウムイオンNa+があります。
しかしナトリウムイオンは電子をもらいません。
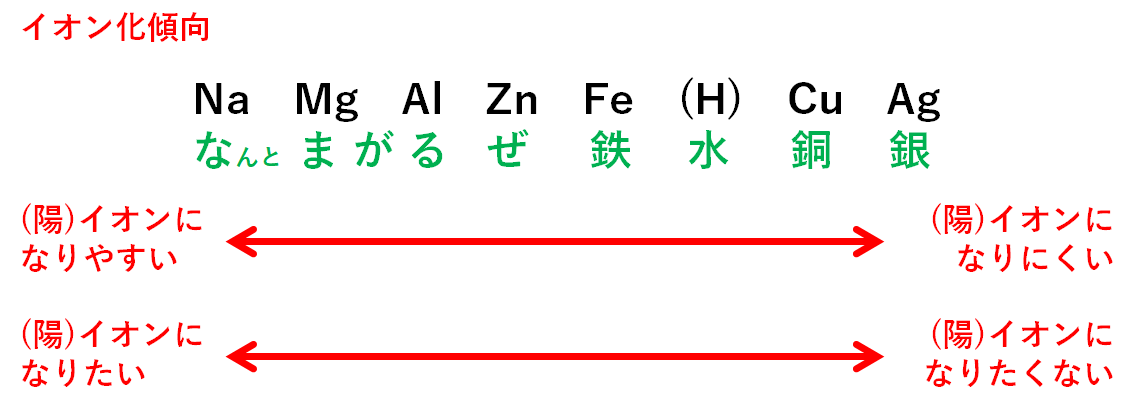
それはイオン化傾向が原因です。
ナトリウムNaはイオン化傾向が大きいです。
イオン化傾向大=イオンになりやすい(イオンのままでいたい)
ということです。
このためナトリウムイオンNa+はそのままで変化しません。
代わりに電子を得るのが、容器内にたくさん存在する水分子H2Oです。
水分子が電子を得て水素が発生するという、中学ではあまり見ない反応が起こります。
式で書くと
2H2O + 2e- → H2 + 2OH-
という反応です。
よって陰極からは水素が発生します。(↓の図)
【陽極で起こったこと】
・水酸化物イオンが近づき電子を失った。
・式で書くと 4OH- → O2 + 2H2O + 4e- ※e-は電子のこと。
【陰極で起こったこと】
・水分子が近づき電子を得た。
・式で書くと 2H2O + 2e- → H2 + 2OH-
【全体として】
・水が水素と酸素へと変化した。
・化学反応式で書くと 2H2O → 2H2 + O2
・液中の水のみが減少するので水酸化ナトリウム水溶液としての濃度は上がっていく。
POINT!!
・水は電気を通しにくい。
→ 水は電離しにくいため、イオンがあまりない。
→ 少しでもイオンを増やそう。
→ そのために水酸化ナトリウムを溶かす。
・陽極では OH- が近づき、電子を失う。
・陰極では H2O が近づき、電子を得る。
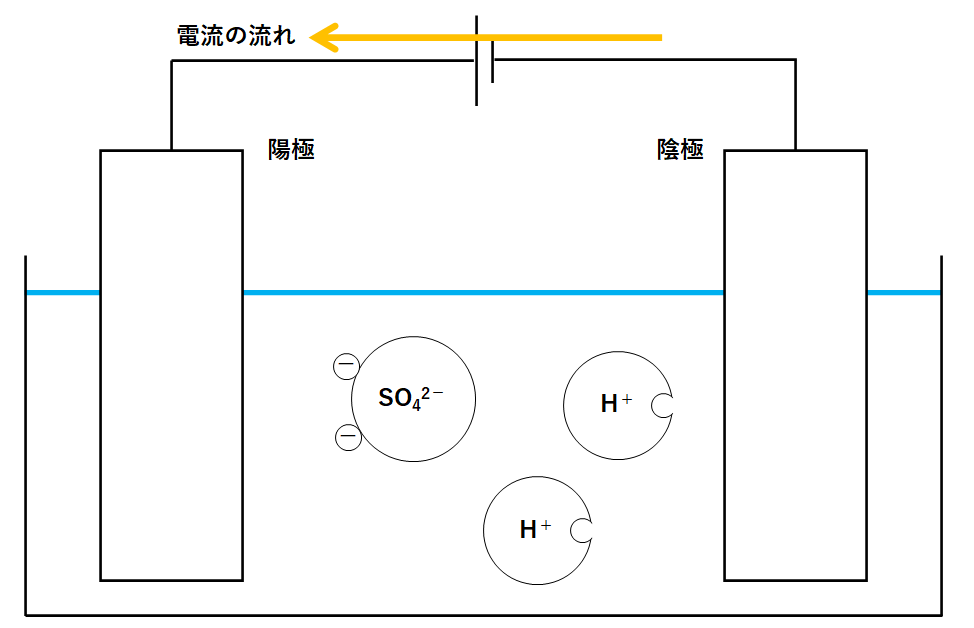
[Ⅱ] 硫酸の場合
水を容器に入れます。
水はごくわずかしか電離しません。
そこで硫酸を加えます。
硫酸は次のように電離します。
電離式: H2SO4 → 2H+ + SO42-
よって↓の図のように各イオンが存在します。
ここに電源装置をつなぎます。
↓のように電流が流れます。
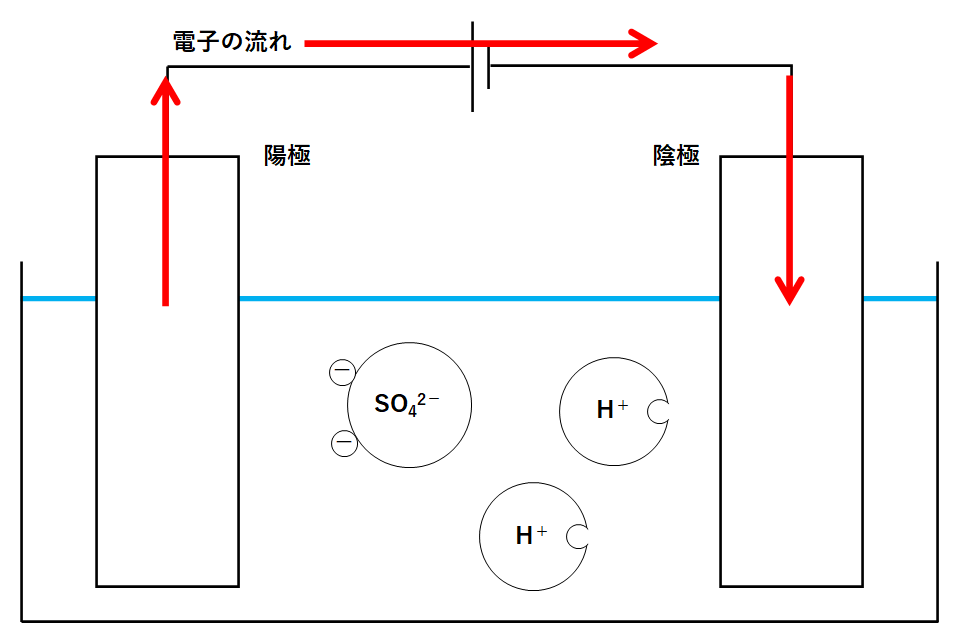
電流の正体は電子の流れです。
しかし電流の流れは電子の流れと反対向きでした。(↓の図)
電源装置は電子を動かす役目をします。
そのためには陽極で誰かから電子を渡してもらう必要があります。
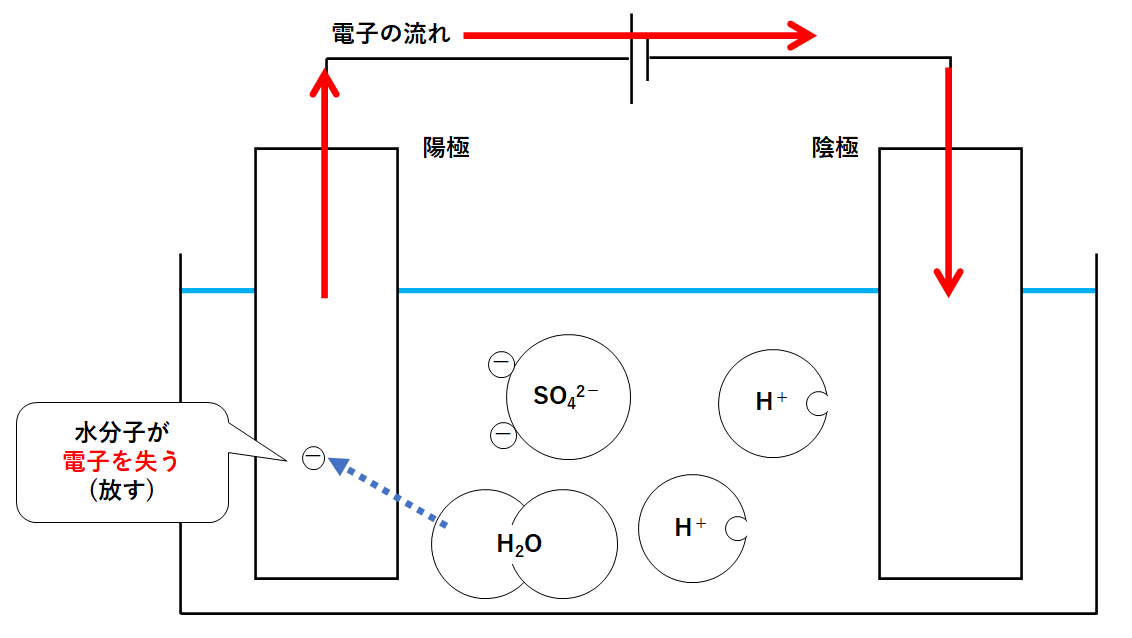
容器内で電子を多く持っているのは陰イオンである硫酸イオンSO42-です。
しかし硫酸イオンは反応しにくいイオンです。
そのため硫酸イオンの代わりに、容器にたくさんある水分子H2Oが電子を陽極に渡します。
式で書くと次のような反応です。
2H2O → O2 + 4H+ + 4e-
このように陽極側では酸素の気体が発生するのです。(↓の図)
※水酸化ナトリウムを溶かした場合は水酸化物イオンOH-が反応していましたが、硫酸は酸性です。そのため、水酸化物イオンOH-は存在しません。
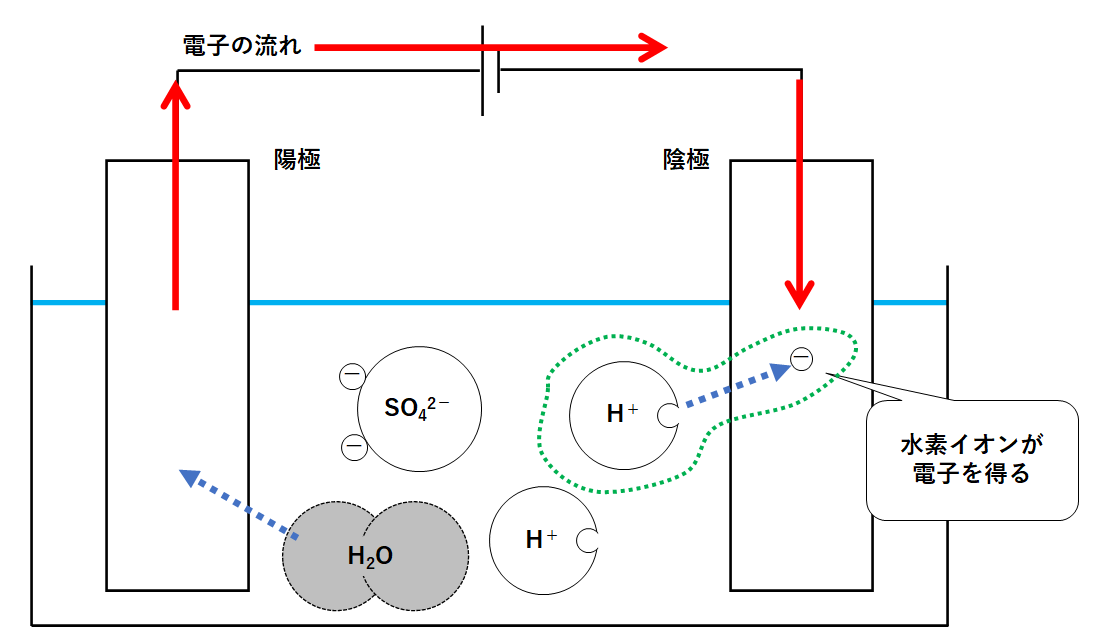
陽極には水分子が置いていった電子があります。
この電子は電源装置によって陰極に運ばれます。(↓の図)
放っておくと電子はたまりっぱなしです。
誰かに持って行ってもらう必要があります。
陰極にたまった電子をもらうのが水素イオンH+です。
式で書くと
2H+ + 2e- → H2
という反応です。
よって陰極からは水素が発生します。(↓の図)
【陽極で起こったこと】
・水分子が近づき電子を失った。
・式で書くと 2H2O → O2 + 4H+ + 4e- ※e-は電子のこと。
【陰極で起こったこと】
・水素イオンが近づき電子を得た。
・式で書くと 2H+ + 2e- → H2
【全体として】
・水が水素と酸素へと変化した。
・化学反応式で書くと 2H2O → 2H2 + O2
・液中の水のみが減少するので硫酸としての濃度は上がっていく。
POINT!!
・水は電気を通しにくい。
→ 水は電離しにくいため、イオンがあまりない。
→ 少しでもイオンを増やそう。
→ そのために硫酸を溶かす。
・陽極では H2O が近づき、電子を失う。
・陰極では H+ が近づき、電子を得る。




コメント(承認された場合のみ表示されます)
質問があります。
全体の反応により、水酸化ナトリウムの濃度が濃くなるとありますが、陽極の反応で水も生成されるのであれば、濃度は変わらなくなるのではないですか?もーすぐテストがあるので、知りたいです。。
匿名希望様
コメントありがとうございます。
陽極の反応では水が生成しますが、それよりも分解される水の方が多いです。
生成する水<分解される水なので、全体としては「水が減少した」となります。
そのため水酸化ナトリウムの濃度は濃くなっていきます。
OH-なのに酸素が出てくるのが疑問だったのですが、解決しました。
質問なのですが、水素と酸素の出てくる量が違うのはなぜですか?
sss様
コメントありがとうございます。
2H2O→2H2+O2
の反応式の通り、
水素2分子に対して、酸素1分子と発生するからです。
これによって発生する気体の体積が異なることとなります。
また水素と酸素では原子1個の質量もまったく異なるので、質量も異なる割合で発生します。
このサイトを見る限り、次のような化学反応式は合っているのでしょうか?
4 H2O → (4 H+)+(2 OH-)
(4 H+)+(2 OH-) → (2 H2O)+(O2)+(2H2)
レポートの期限が近いのでよろしくお願いします!
じょう様
コメントありがとうございます。
その反応式で合っていますね。
それをもっとも簡略化すると
2H2O→2H2+O2
となります。
陽極の水溶液ににおいや漂白作用はありますか?
中村様
コメントありがとうございます。
水の電気分解では、陽極には酸素が発生します。
しかし酸素は水に溶けないため、水溶液とはなりません。
またにおいも漂白作用もない気体です。
においや漂白作用があるのは塩素ですね。
塩酸や塩化銅水溶液の電気分解で陽極側に発生する気体です。
質問があります。
陰極では水素イオンが近づき、電子を受け取って水素になることを理解しました。
他のサイトでは水自体が陰極で電子を受け取って水素と水酸化物イオンになると解説してます。
どちらが正しいのでしょうか?
ゆうすけ様
コメントありがとうございます。
水は電気を通しにくいので、水酸化ナトリウムや硫酸を加えます。
厳密な話をすると
硫酸を用いた際は
2H+2e-→H2
の反応が起こります。
水酸化ナトリウム水溶液を用いた際は
2H2O+2e-→2OH-+H2
の反応が起こります。
これはアルカリ性の条件下ではH+はほぼ存在しないためです。
中学内容なのであえて一方のみしか書きませんでしたが、ややこしいですね。
これを機に記事を改訂させていただきます。
ありがとうございます。
『水の電気分解』で、水(H2O)の状態では、電気を通さないので、水酸化ナトリウム(NaOh)等を加えて、陰極側に水素、陽極側に酸素を発生させる実験についての解説で、どうしても納得出来ない箇所が
あります。それは、陰極側の水素が、発生する理由として、Na+(ナトリムイオン)が、イオン化傾向が大きい為、イオンのままでいる為、水(H2O)が反応して、2H2O + 2e- → H2 + 2OH-で水素が発生すると説明がありました。本来、水だけでは、電気分解しない(イオン化しにくい)ので、水酸化ナトリウムを加えたのに、結果、Na+がイオン化が原因で、水がすると言うのは、説明された論理に矛盾してないでしょうか?私には、そう判断されますが。水酸化ナトリウム(NaOh)が、トリガーになり、水だけは、イオン化しないの水が、大変身?するのでしょうか?
坊主さん様
コメントありがとうございます。
たしかに水だけでは反応をしません。
水はほとんど電離をしないので。
ですが、硫酸や水酸化ナトリウムを入れます。
これでイオンが増えます。
つまり電流が流れます。(電子のやり取りが起こる)
その際に、電子を受け取る役割を求められる存在がいます。
それが水分子ということです。
坊主さん様の言い方を使わせていただくと、水酸化ナトリウムがトリガーになるということです。
先日の中間テストで
5%の水酸化ナトリウム水溶液120g(密度1g/㎤)を電気分解する問題が出題されました。
気体の発生量のグラフが与えられ、1分間当たり0.75㎎の水が分解されていると計算できるもので、4.5㎎の水溶液が分解されるのにかかる時間を問う問題がありました。
また、別の問いで、水酸化ナトリウム水溶液の濃度変化を問う問題もありました。
そこで質問です。
全体の水溶液の量に値して、分解される水の量はごくごくわずかであり、この数値が与えられている問題において、水溶液の濃度がほとんど変わらないと考えるのは間違っていますか?
また、問題では、6分で水素6㎤、酸素3㎤の発生量が与えられています。
「6分間の気体の合計発生量9㎤に対して、分解された水の量0.0045㎤は2000分の1であるため、水酸化ナトリウム水溶液の濃度はほとんど変化しない」と考えました。
U4様
コメントありがとうございます。
>全体の水溶液の量に値して、分解される水の量はごくごくわずかであり、この数値が与えられている問題において、水溶液の濃度がほとんど変わらないと考えるのは間違っていますか?
>6分で水素6㎤、酸素3㎤の発生量が与えられています。
>「6分間の気体の合計発生量9㎤に対して、分解された水の量0.0045㎤は2000分の1であるため、水酸化ナトリウム水溶液の濃度はほとんど変化しない」と考えました。
この場合、計算してみましたが0.0002%程度しか濃度の上昇はありませんね。
個人的には、この数値であればほぼ濃度は変わっていないと言ってよいと思います。
学校の先生がどうおっしゃられるのかはわかりませんが、興味ありますね。