ここでは「アンモニアの毒性」「アンモニアの塩」「アンモニアの製法」「オストワルト法」などについてくわしく解説していきます。
発展的な内容を含みます。
というかマニアックなので高校入試にはそんなに出ません・・・。
1.アンモニアの基本的な性質
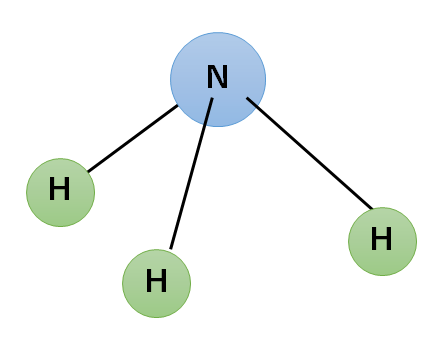
化学式はNH3。
窒素原子1つと水素原子3つが↓のように四面体の構造をしています。
■アンモニアの基本的な性質
中学1年生で学習する性質としては次のようなものがある。
・水に溶けやすい。
・空気より軽い。
→ そのため上方置換法で集めるのが適切。
・水に溶けるとアンモニア水となり、アルカリ性を示す。
・鼻をさすようなにおいがある。(刺激臭)
・有毒である。
定期試験レベルなら以上を押さえていればだいじょうぶです。
ここから先は結構マニアックです!
2.*アンモニアの電離
アンモニアは上記の通り、水に溶けやすいです。
そして、その水溶液はアルカリ性を示します。
このとき次のような反応が起こっています。
NH3 + H2O → NH4+ + OH-
水に溶けたとき、水酸化物イオンOH-が生じるため、アルカリ性であるといえます。
しかしpHはさほど高くはなく、割と弱いアルカリ性です。
ここでNH4+をアンモニウムイオンと呼びます。
アンモニウムイオンは中和反応のとき、さまざまな酸と塩をつくります。
アンモニウムイオンによってできる塩には次のようなものがあります。
塩化アンモニウム NH4Cl
塩酸とアンモニアの中和によってできる。(反応式・・・HCl + NH3 → NH4Cl)
無色の固体。
別名を塩安(えんあん)という。
肥料として用いられる。
または肥料の材料としても用いられる。
硫酸アンモニウム (NH4)2SO4
硫酸とアンモニアの中和によってできる。(反応式・・・H2SO4 + 2NH3 → (NH4)2SO4)
無色の固体。
別名を硫安(りゅうあん)という。
代表的な肥料の1つ。
水を加えると吸熱反応が起こる。
硝酸アンモニウム NH4NO3
硝酸とアンモニアの中和によってできる。(反応式・・・HNO3 + NH3 → NH4NO3)
無色の固体。
別名を硝安(しょうあん)という。
代表的な肥料の1つ。
水を加えると発熱する。
この性質を利用して爆薬に使用されることもある。
POINT!!
アンモニアは窒素原子を含む肥料(窒素肥料)の原料となる!
3.アンモニアの毒性
人体の中でアミノ酸が分解されると(細胞呼吸によって分解されます)アンモニアが生じます。
しかしアンモニアは毒性があります。
そのため、何とか早めに処理しなくてはなりません。
そこで血液によって肝臓まで運ばれます。
肝臓では、アンモニアは毒性の低い尿素へとつくりかえられます。
そして尿素は、血液によって腎臓に運ばれます。
腎臓は、やってきた血液中の尿素を取り除き、ぼうこうにたくわえておいてくれます。
そしていらない塩分や水分とともに尿として排出されます。
※より詳しい仕組みは→【*腎臓・排出のしくみ】←を参考に。
4.*アンモニアの合成方法
ハーバー・ボッシュ法
現在、もっとも主流であるアンモニアの合成方法です。
水素と窒素を高温高圧のもと反応させます。
反応式・・・N2 + 3H2 → 2NH3
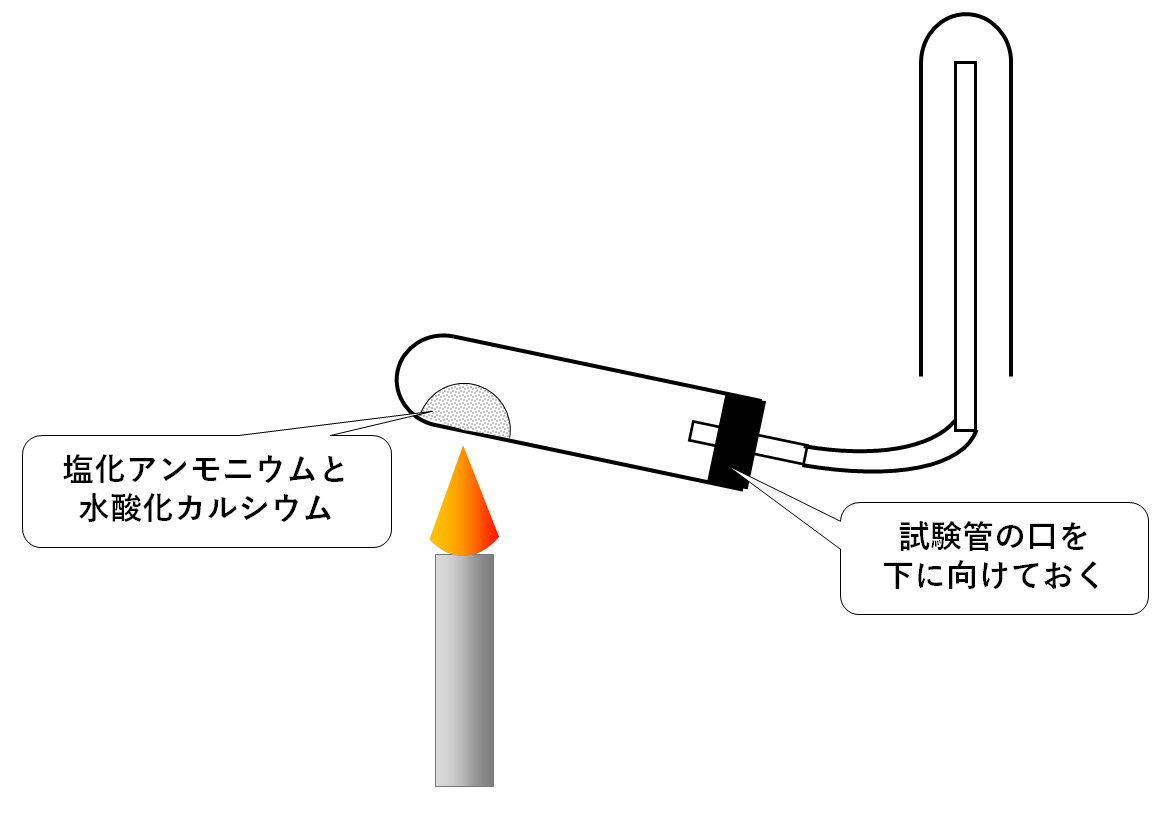
塩化アンモニウム+水酸化カルシウム
塩化アンモニウムNH4Clは、アンモニウムイオンNH4+に塩化物イオンCl-が結びついたもの。
アンモニアは弱いアルカリ性ですので、塩化アンモニウムは弱アルカリが塩になったものと言えます。
そこに水酸化カルシウムCa(OH)2を加えます。
水酸化カルシウムは強いアルカリ性。
このとき塩化アンモニウム中のアンモニウムイオンの居場所は水酸化カルシウムにうばわれてしまいます。
水酸化カルシウムによって居場所を追われたアンモニウムイオンは、アンモニアとなり単独行動せざるを得なくなります。
このように、弱アルカリの塩は、強アルカリに居場所をうばわれ、追い出されます。
(このような反応を弱塩基遊離反応といいます。)
この様子を化学反応式で書くと
2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O +2NH3
です。
POINT!!
弱アルカリの塩+強アルカリの反応では・・・
→弱アルカリは、強アルカリに居場所をうばわれ、追い出される!
ちなみにこの実験では、次の図のように試験管の口を下に向けておく必要があります。
発生した水が加熱部分に流れて、試験管が割れるのをふせぐためです。
5.*オストワルト法
オストワルト法とは、アンモニアから硝酸HNO3を生産する方法です。
高校で学習する内容です。
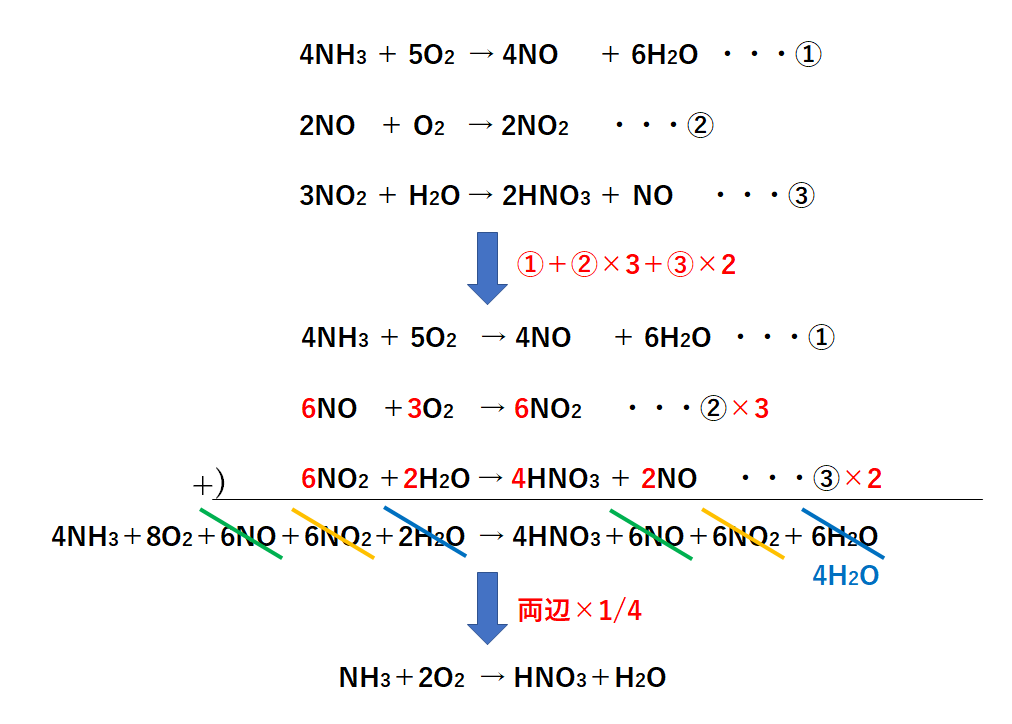
オストワルト法では3段階に分かれます。
①アンモニアを酸化する
反応式・・・4NH3 + 5O2 → 4NO + 6H2O
ここでは一酸化窒素NOを生成させます。
②一酸化窒素NOを酸化する
反応式・・・2NO + O2 → 2NO2
ここでは二酸化窒素NO2を生成させます。
③二酸化窒素NO2を水で酸化する
反応式・・・3NO2 + H2O → 2HNO3 + NO
ここで発生した一酸化窒素NOは②に再利用されます。
①~③の反応式を1つにまとめると↓のようになります。
よってアンモニアから硫酸が生産される反応は以下の反応式で表されます。
NH3 + 2O2 → HNO3 + H2O
このようにして酸化をすることによって硝酸を生産します。
POINT!!
アンモニアを酸化することで硝酸をつくることができる!

コメント(承認された場合のみ表示されます)