このページでは塩化銅水溶液の電気分解を例に「電気分解の原理」「陽極や陰極ではどのような変化が起こっているか?」を解説しています。
※できれば→【イオンとは】←や→【電離・電解質】←も参考に。
※塩酸の電気分解の原理は→【塩酸の電気分解】←を参考に。
※水の電気分解の原理は→【水の電気分解】←を参考に。
動画による解説は↓↓↓
チャンネル登録はこちらから↓↓↓
1.塩化銅水溶液の電気分解
■分解
1つの物質が2つ以上の物質に変化する化学変化。
■電気分解
電気を通すことで行う分解。
電気エネルギーを化学エネルギーに変換している。
■塩化銅水溶液
水に塩化銅を溶かした水溶液(青色の液体)。
塩化銅は次のように電離する。
電離のようす・・・ CuCl2 → Cu2+ + 2Cl-
塩化銅水溶液が青色をしているのは銅イオンCu2+が原因。
※「銅原子は赤色」ですが「銅イオンは青色」です。注意!
■塩化銅水溶液の電気分解
(反応の様子) 塩化銅 → 銅 + 塩素
(化学反応式) CuCl2 → Cu + Cl2
2.塩化銅水溶液の電気分解の仕組み
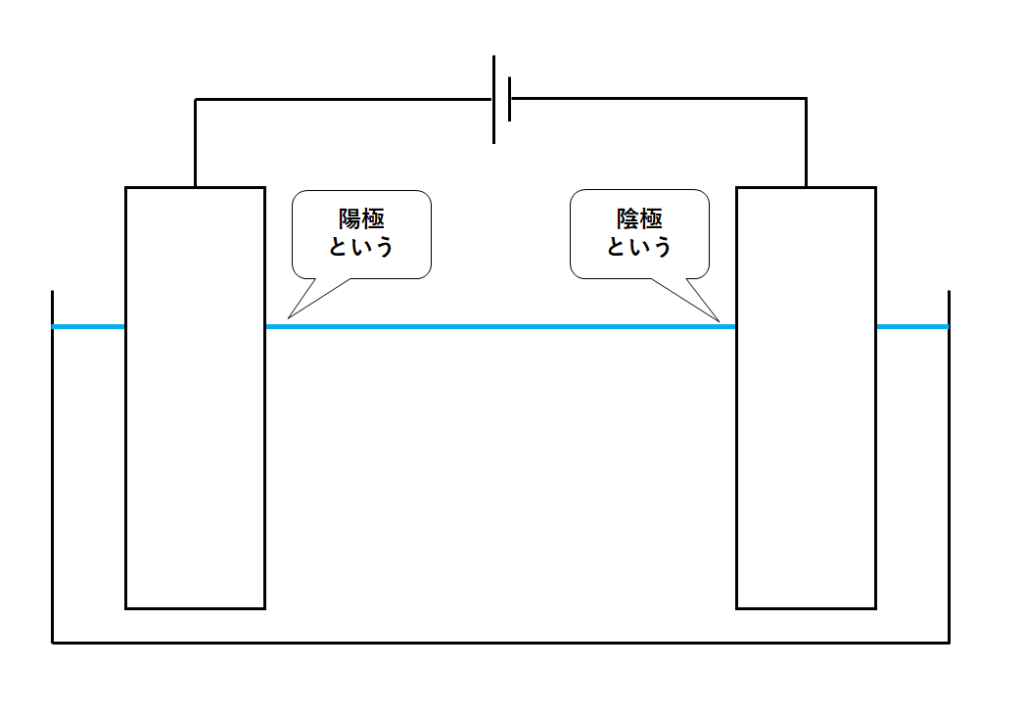
■陽極・陰極
電源の+極からつながっている電極が陽極。
電源の-極からつながっている電極が陰極。
※電極には他の物質と反応しにくい炭素や白金を用いることが多い。
POINT!!
電気分解は、次のイメージを持っておこう!
→ 溶液に電気を流す。つまり溶液中の電子を動かす。
→ 溶液中のイオンが無理やり電子を受け渡しさせられて、原子にもどる反応のこと!
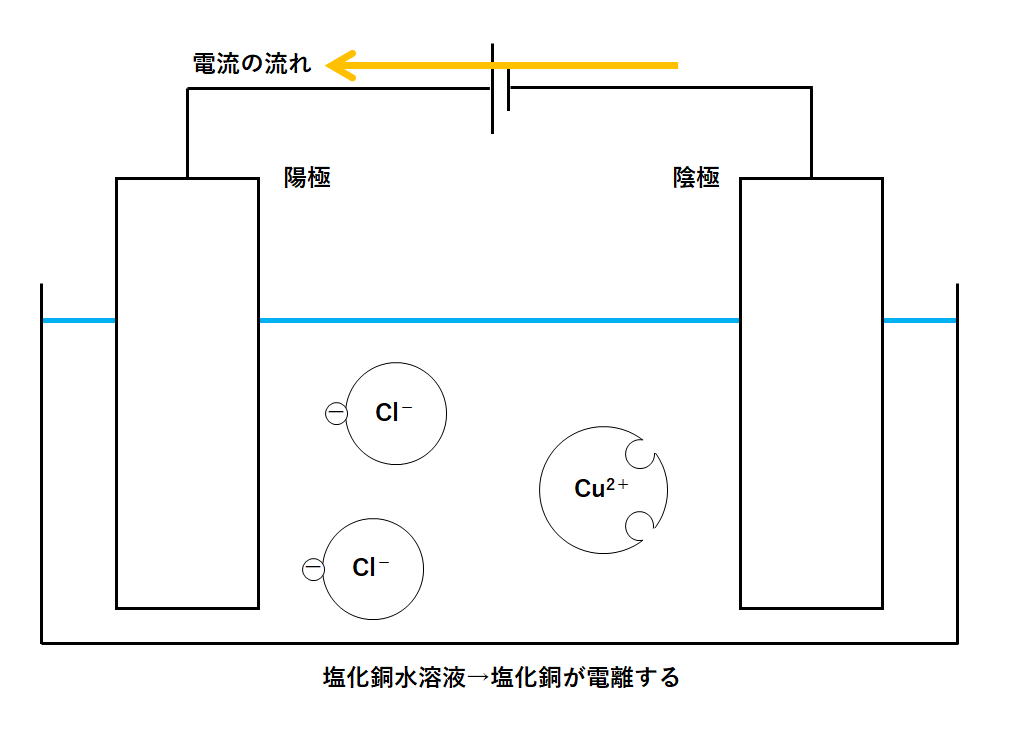
①容器に塩化銅水溶液を入れる
容器に塩化銅水溶液を入れます。
この水溶液中では塩化銅が銅イオンと塩化物イオンに電離しています。
↓の図のように、容器の中には銅イオンと塩化物イオンが存在しているわけです。
②電流が流れだす
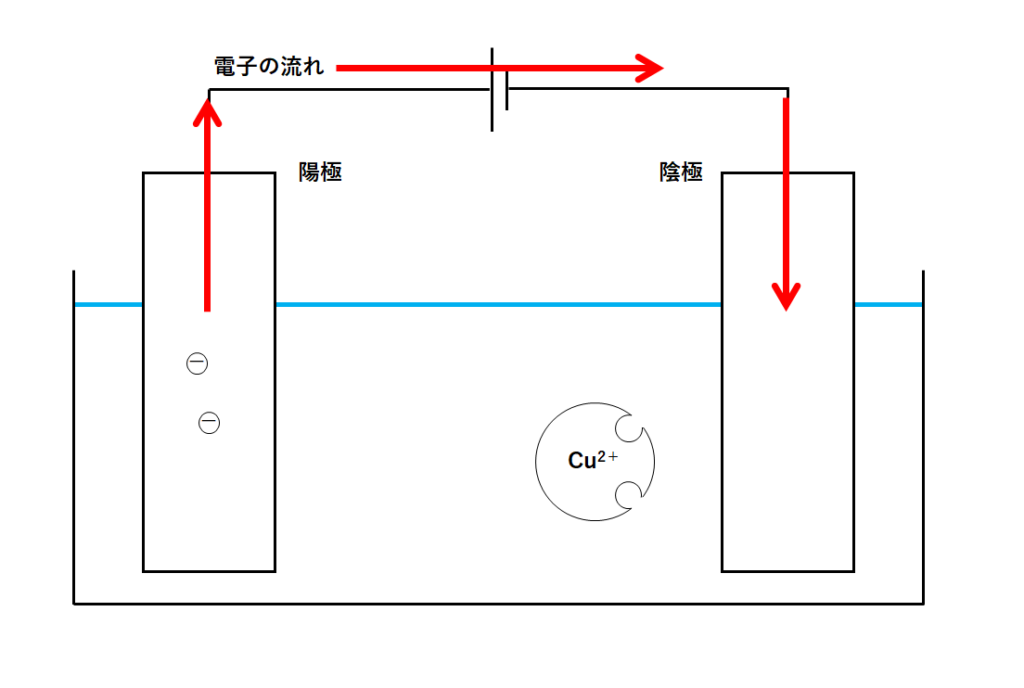
容器の電極に電源装置をつなぎ、電流を流します。
電流は↓のような向きに流れますね。
③電子の流れ
電流の正体は電子の流れです。
しかし電流の流れは電子の流れと反対向きでした。
よって電子は、↓の図の矢印の向きに動いています。
電源装置は電子を動かす役目をします。
陽極から陰極へ電子を動かすのです。
ということは、陽極でだれかから電子をもらわないと、電子を動かせません。
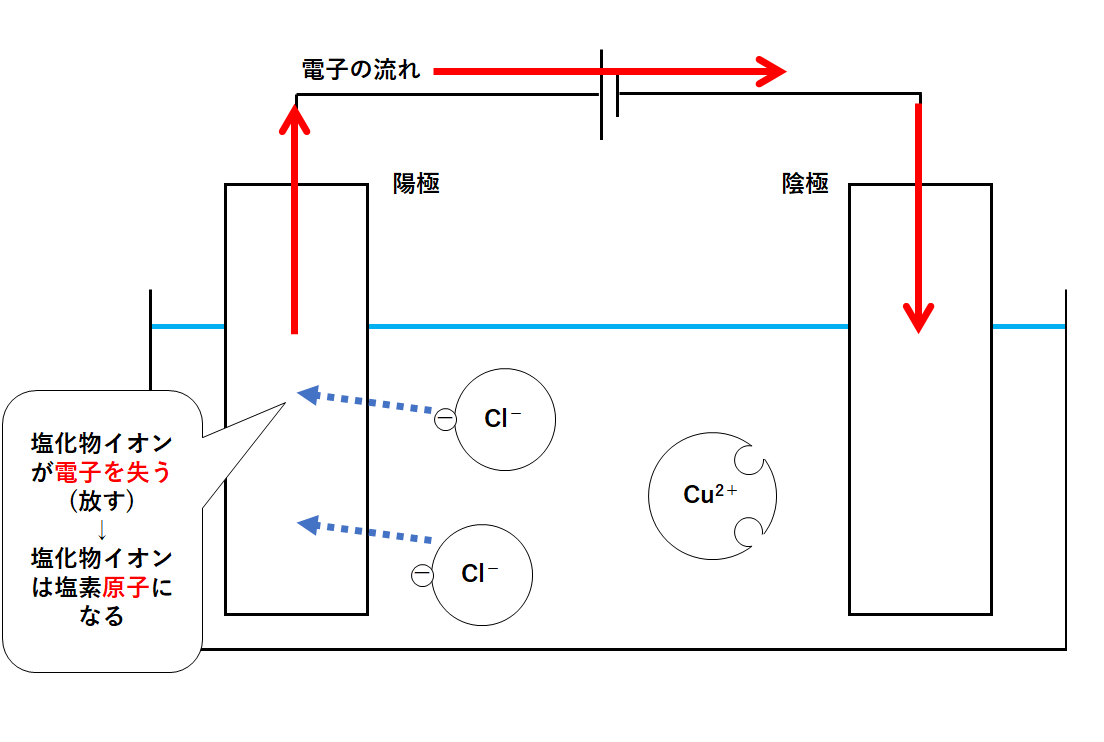
④陽極での変化
では、だれから電子を受け取ればいいでしょうか?
この容器内で電子を多くもっているのは塩化物イオンCl-です。
塩化物イオンCl-はもともと塩素原子。
塩素原子が電子を得ることで、塩化物イオンCl-になっているのです。
(よくわからない人は→【イオンとは】←を読んでみてください。)
よって塩化物イオンCl-が電子を渡すのがよさそうです。
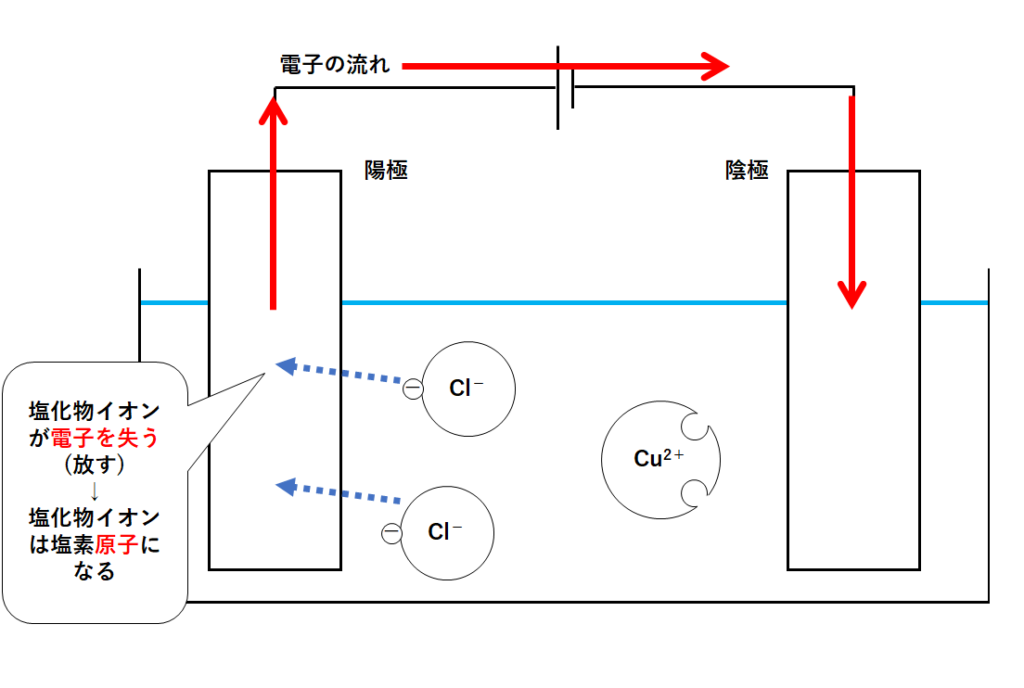
塩化物イオンは、陽極に近づいて電子を渡します(陽極に渡す)。
塩化物イオンは電子を失うことで塩素原子となります。(↓の図)
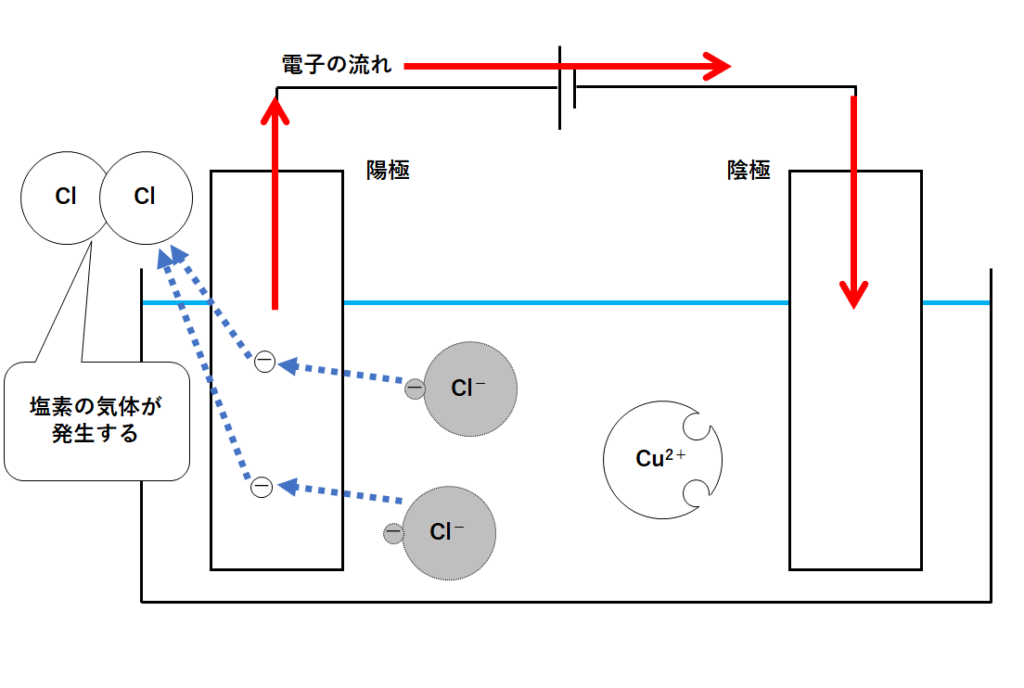
その塩素原子が2つ結びつくと塩素の気体Cl2となります。
このように陽極側では塩素の気体が発生するのです。(↓の図)
⑤電子の移動
陽極には塩化物イオンが置いていった電子がありますね。(↓の図)
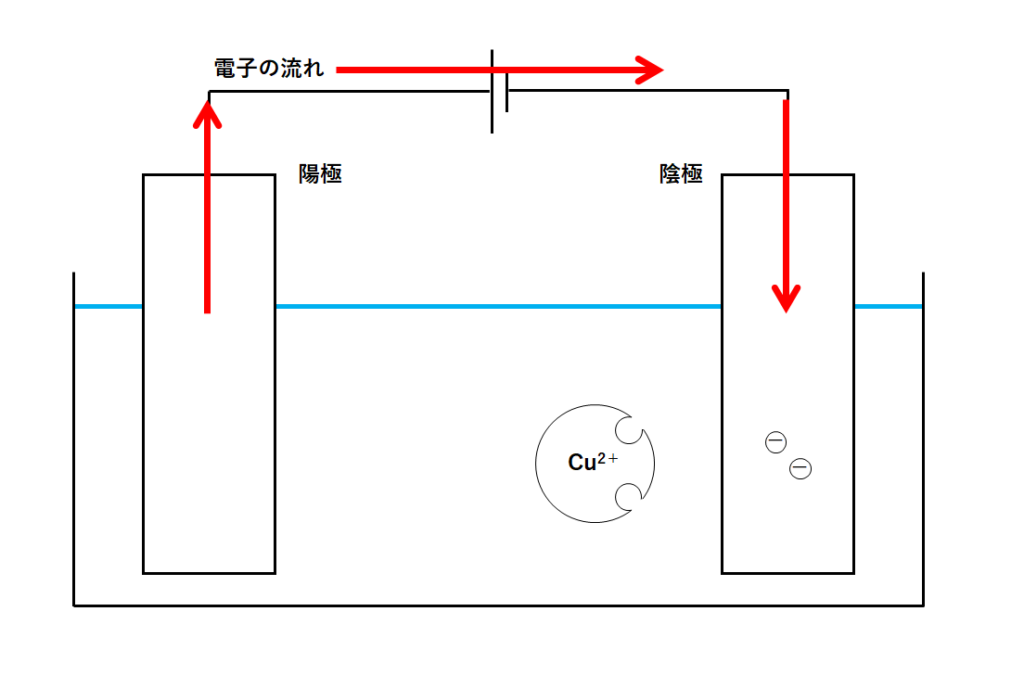
この電子は電源装置のはたらきによって陰極に運ばれます。(↓の図)
放っておくと陰極には電子がどんどんとたまっていきます。
誰かに持って行ってもらわなければいけません。
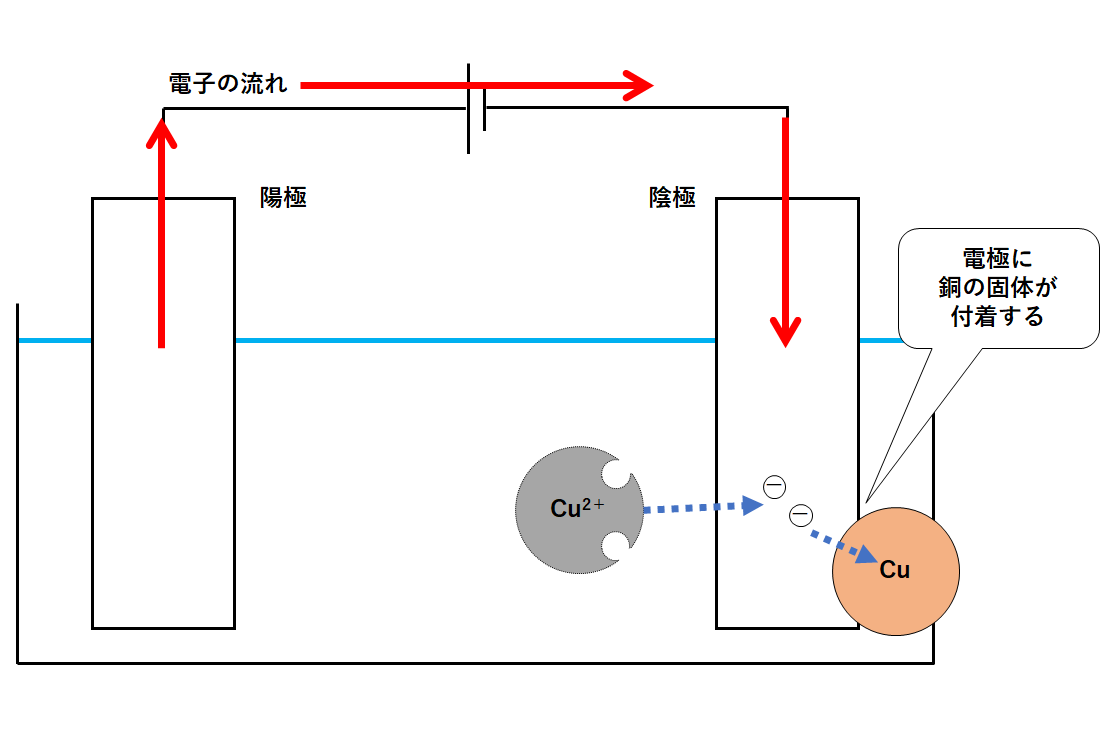
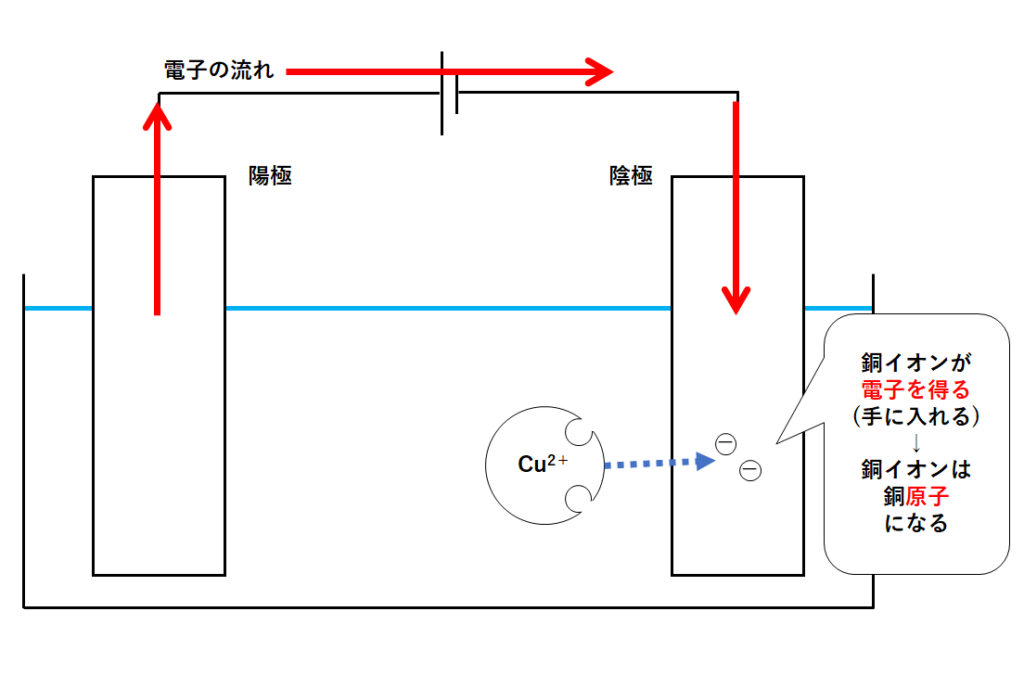
⑤陰極での変化
では、だれが陰極にたまった電子を持って行ってくれるのでしょうか?
それは銅イオンCu2+です。
銅イオンCu2+は、もともと銅原子。
銅原子が電子を2個失って、銅イオンCu2+になっています。
つまり、銅イオンは、銅原子が電子を失くしてしまっている状態。
そんな銅イオンは陰極に近づき、陰極にたまっている電子をもらいます(陰極から電子を得る)。
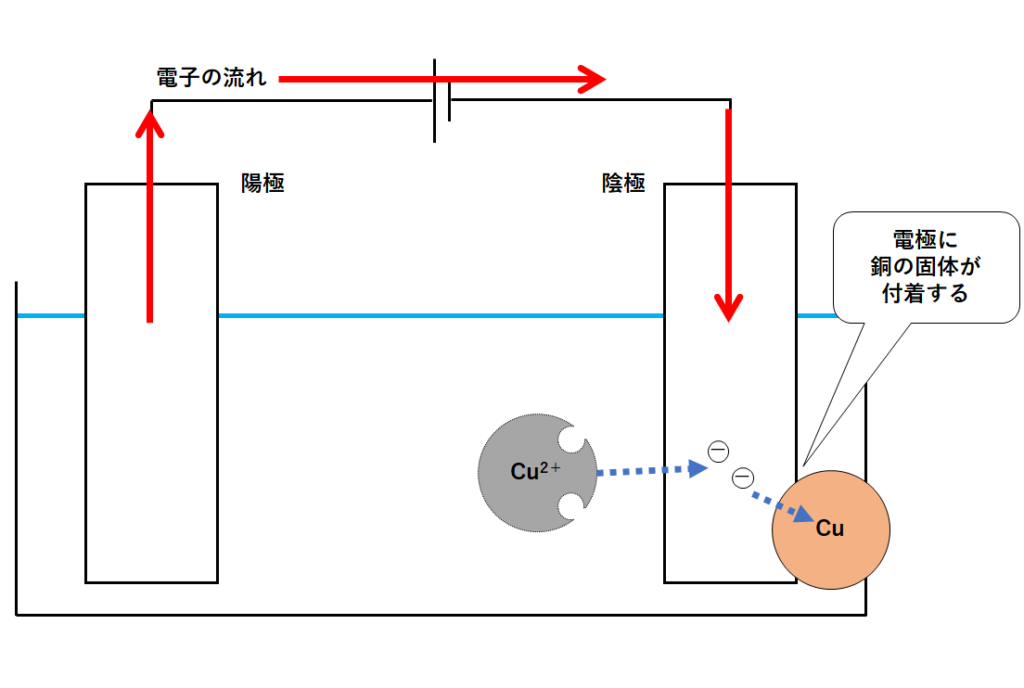
そうすることで銅イオンは銅原子となります。(↓の図)
このように陰極側では銅の固体が生成する(陰極に銅の固体が付着)のです。
⑥まとめ
【陽極で起こったこと】
・塩化物イオンが近づき、電子を失った。
・式で書くと 2Cl- → Cl2 + 2e-
※e–は電子のことです。
【陰極で起こったこと】
・銅イオンが近づき、電子を得た。
・式で書くと Cu2+ + 2e- →Cu
※陰極側の電極は銅が付着するので赤色になっていきます。
【全体として】
・水溶液中の塩化銅が塩素の気体と銅の固体へと変化した。
・化学反応式で書くと CuCl2 → Cu + Cl2
・液中の銅イオン(水溶液が青色をしている原因)が減少する。
・よって液の青色はうすくなる。
このように電気分解では、電源装置が電子を動かすため
塩化物イオンCl-が電子を失い、銅イオンが電子を得る
という反応が起こります。
その結果、
塩化物イオンは塩素原子になり、銅イオンは銅原子になる
こととなります。
これが電気分解の基本原理です。
POINT!!
▼陽極で起こること、陰極で起こることを説明できるようになっておこう。
(式で表せるとなおよい)
・陽極では、塩化物イオンが電子を失った。
・陰極では、銅イオンが電子を得た。
・電気分解が進むほど、銅イオンは銅原子へと変化する。そのため液の青色はうすくなっていく。
▼塩素の性質も知っておこう。
・プールの消毒のにおい。
・脱色作用がある。(赤インクを近づけると、赤色が抜ける)
・水に溶けやすい。

コメント(承認された場合のみ表示されます)
少し気になったことがあるのでコメントさせていただきます。
塩化銅水溶液を分解し続けた場合濃度が薄くなって最終的には純粋な水になるのでしょうか?
それとも塩化銅が少量残ったまま反応しなくなるのでしょうか?
匿名の高校生様
コメントありがとうございます。
理論上は純粋な水になると思いますが、実際にやると時間をかけても塩化銅がごくごく少量なかなか分解されない、ということが起こると思います。
すごく分かりやすくていつもテスト勉強に重宝してます。ありがとうございます。
質問です。電池ではなく電源装置と電流計をミノムシクリップつないで炭素棒電極を使用し、電気分解をする実験についてです。(分かりにくくてすいません)
簡易的にこんな感じです↓
|━━━━━━━(-)電源装置(+)
炭 炭 |
素 素 |
棒 棒━━━━━ (-)電流計(+)
(陰) (陽)
電子の流れ方が分からなくて、炭素棒の陽極から炭素棒の陰極へ電子が流れるんですか?
中3様
返信が遅くなり申し訳ありません。
コメントありがとうございます。
こういうことでしょうか?ご確認いただけますと幸いです。