1.主な金属の性質
■金属に共通する性質
①金属光沢をもつ。
②電気伝導性がある。(電気をよく通す)
③熱伝導性が大きい。(熱をよく通す)
④展性、延性がある。(たたくとうすく広がる(展性)・のびる(延性))
■金属・非金属の見分け方(覚え方)
①漢字で「金」が入っている・・・銀・銅・鉛・亜鉛など。
②「~ウム」という名前・・・カルシウム・マグネシウムなど。
※ヘリウムは金属ではない。
■カリウムK
*常温で水と激しく反応して水酸化カリウムKOHになる。
*肥料の三大元素(リンP・窒素N・カリウムK)の1つ。
イオンになるとK+という1価の陽イオン。
■カルシウムCa
*常温で水と反応し水酸化カルシウムCa(OH)2となる。
イオンになるとCa2+という2価の陽イオン。
※消石灰・・・水酸化カルシウムCa(OH)2のこと。
※生石灰・・・酸化カルシウムCaOのこと。
※石灰石・・・炭酸カルシウムCaCO3のこと。
■ナトリウムNa
*常温で水と激しく反応して水酸化ナトリウムNaOHとなる。
*灯油の中などで保存される。
イオンになるとNa+という1価の陽イオン。
■マグネシウムMg
銀白色の金属。
空気中で加熱すると強い光を出して酸化(燃焼)する。
このとき、白色の酸化マグネシウムMgOが生じる。
うすい塩酸や硫酸と反応し水素H2が発生する。
イオンになるとMg2+という2価の陽イオン。
■アルミニウムAl
銀白色の金属。
空気中で加熱すると酸化アルミニウムAl2O3となる。
うすい塩酸や硫酸と反応し水素H2が発生する。
さらにアルカリとも反応し水素H2が発生する。
イオンになるとAl3+という3価の陽イオン。
■亜鉛Zn
銀白色の金属。
*空気中で加熱すると酸化亜鉛ZnOとなる。
うすい塩酸や硫酸と反応し水素H2が発生する。
さらにアルカリとも反応し水素H2が発生する。
イオンになるとZn2+という2価の陽イオン。
■鉄Fe
銀白色の金属。
磁石に引き寄せられる。
細い繊維状にしたものをスチールウールという。
スチールウールを空気中で熱すると強い光を出して酸化する(燃焼)。
*鉄の酸化物には3種類あってそれぞれFeO・Fe2O3・Fe3O4と表される。
うすい塩酸や硫酸と反応し水素H2が発生する。
■銅Cu
赤色(または赤褐色)の金属。
空気中で加熱すると黒色の酸化銅CuOとなる。
うすい塩酸や硫酸とは反応しない。(イオン化傾向が小さいため)
イオンになるとCu2+という2価の陽イオン。
■銀Ag
銀白色の金属。
うすい塩酸や硫酸とは反応しない。(イオン化傾向が小さいため)
イオンになるとAg+という1価の陽イオン。
その他の金属の性質まとめ
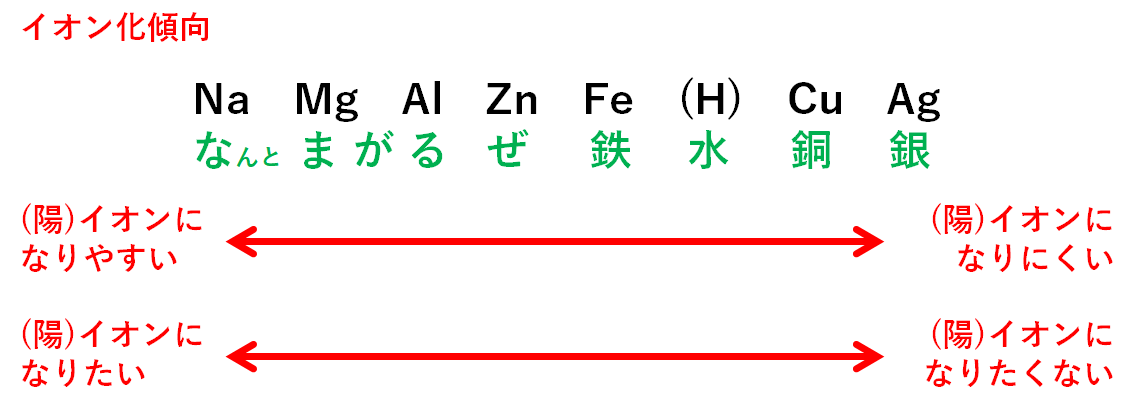
■覚えておきたいイオン化傾向
イオン化傾向とは・・・
その原子がどれだけイオンになりやすいかを順に並べたもの。
すべて陽イオンになるものばかりである。
以下の8種類の元素について、順番を覚えておきましょう。
■両性金属
酸ともアルカリとも反応する金属のこと。
アルミニウムAl・亜鉛Zn(ほかにはスズSn・鉛Pb)
※( )は中学理科では覚えなくてもよい。
■空気中で熱すると燃焼する金属
空気中で熱すると「強い光や熱」が発生する金属のこと。
スチールウール(鉄Feを細い繊維状にしたもの)・マグネシウムMg
■磁石に引き寄せられる金属
鉄Fe(ほかにもコバルトCo・ニッケルNi)
※( )は中学理科では覚えなくてもよい。
■炎色反応
物質を炎に入れると、炎の色が変化する場合がある。
この現象を炎色反応という。
以下の金属のイオンが含まれていると炎の色が変わる。
(以下の金属以外でも、非金属でも炎色反応は起こります。)
Na:黄色 K:赤紫色 カルシウム:橙色 Ba:黄緑色 Cu:青緑色

コメント(承認された場合のみ表示されます)