このページでは「中和反応とはどんな反応か?」「どんな中和反応があるか?」「塩酸と水酸化ナトリウム水溶液の場合はどんな反応?」について解説しています。
前半部分の動画による解説は↓↓↓
後半部分(塩酸と水酸化ナトリウム水溶液の中和)の動画解説はこちら↓↓↓
チャンネル登録はこちらをクリック↓↓↓
1.中和反応
酸とアルカリが反応して互いの性質を打ち消し合う反応。
酸とアルカリが反応して水が生じる反応ともいえる。
酸・アルカリとは…
・酸・・・電離してH+を生じる物質
・アルカリ・・・電離してOH-を生じる物質
という物質でした。
※→【酸とアルカリ】←を参考に。
酸とアルカリを混ぜ合わせると、H+ と OH- が結びついて水 H2O が生じます。
式で書くと
H+ + OH- → H2O
となります。
この反応を中和(中和反応)といいます。
中和という反応では、
・酸性を示す原因であるH+がなくなる
・アルカリ性を示す原因であるOH-がなくなる
そのため、互いの性質を打ち消し合う反応とも説明されます。
中和で水以外に生じる物質のこと。
塩にはさまざまな種類があります。
中和反応の例を通していくつかの塩を見てみましょう。
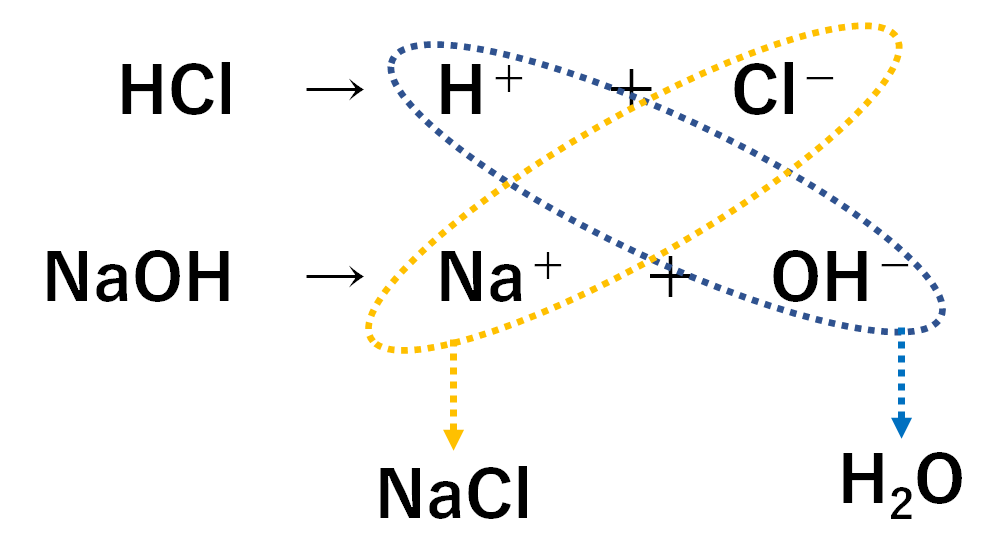
例① 塩酸と水酸化ナトリウム水溶液
塩酸の化学式はHCl、水酸化ナトリウムの化学式はNaOH。
どちらも代表的な強酸、強アルカリです。
この反応では塩化ナトリウム NaCl という塩ができています。
塩化ナトリウムは「食べることができる塩」なので食塩とも呼ばれます。
例② 硫酸と水酸化バリウム水溶液
硫酸の化学式はH2SO4、水酸化バリウムの化学式はBa(OH)2。
これらもよく出題される強酸、強アルカリです。
ここでは硫酸バリウムBaSO4という塩ができます。
硫酸バリウムは白色の固体で、水にとけない塩です。
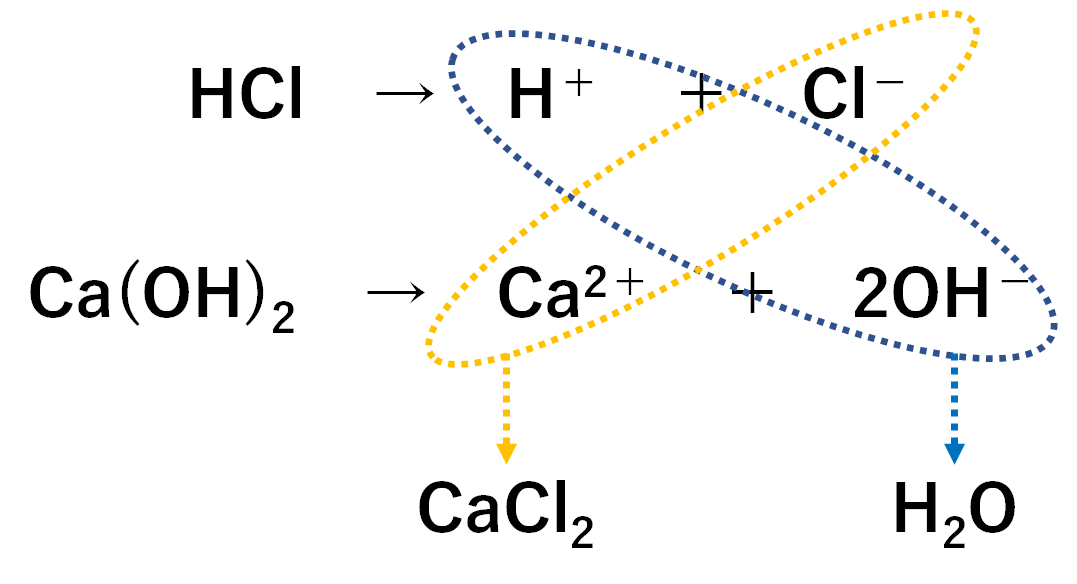
例③ 塩酸と水酸化カルシウム水溶液
塩酸は化学式HCl。
水酸化カルシウムは化学式CaCl2。
ここでは塩化カルシウムCaCl2という塩ができます。
ここでは3種類の塩を紹介しました。
酸とアルカリの組み合わせの分だけ塩の種類は存在します。
間違っても塩(えん)=食塩のことと思い込まないようにしましょう。
ちなみに塩には水に溶けるものと水に溶けずに沈殿になるものがあります。
その代表的なものは次の2つです。
塩化ナトリウムNaCl・・・水に溶ける塩
硫酸バリウムBaSO4・・・水に溶けずに沈殿する塩
2.塩酸と水酸化ナトリウム水溶液の中和
次のような実験で中和について調べたとしましょう。
実験
①ビーカーにうすい塩酸を入れておく。
②このビーカーにBTB溶液を2、3滴加える。
→このときビーカーには塩酸が入っているのでBTB溶液は黄色に変化。
③このビーカーに水酸化ナトリウム水溶液を少しずつ加え、BTB溶液の色の変化を確認する。
→こまごめピペットという器具を使います。
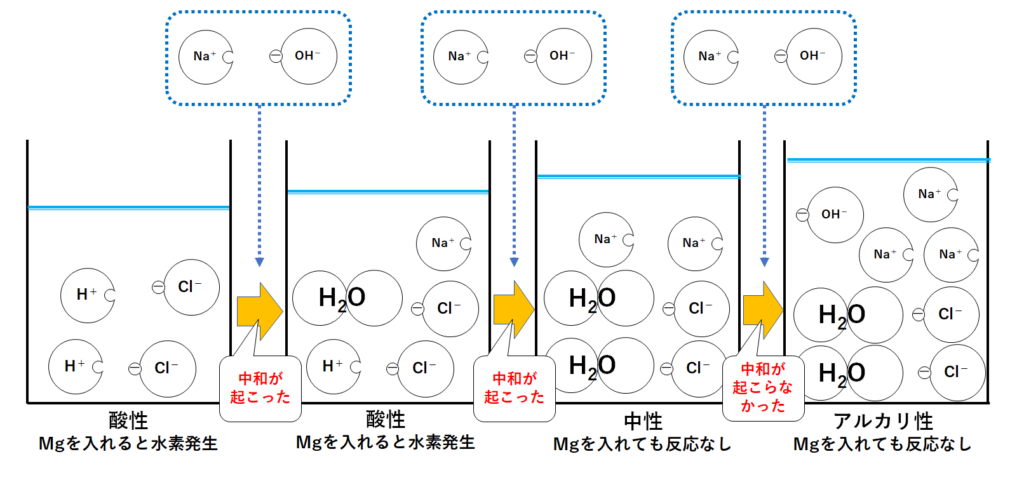
このときのビーカー内で起こっている変化を1つずつ見ていきましょう。
①ビーカーに塩酸のみが入っているとき
塩酸は水に塩化水素が溶けた水溶液です。
塩化水素は水溶液中で
HCl → H+ + Cl-
と電離しています。
ここではビーカーに入ったうすい塩酸を、次のようなモデルで考えてみます。
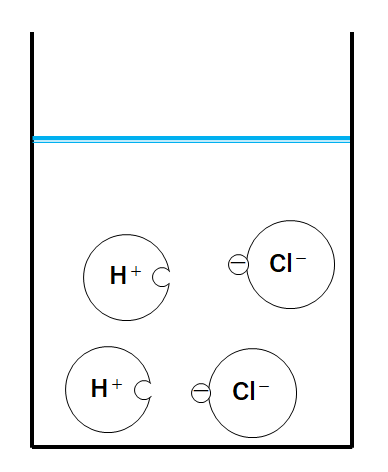
水素イオンH+が2個、塩化物イオンCl-が2個入っています。
(あくまでモデル図、たとえです。こんなにイオンが少ないことは実際にはほぼありえません。)
水素イオンH+があるので溶液は酸性を示します。
よってBTB溶液は黄色になります。
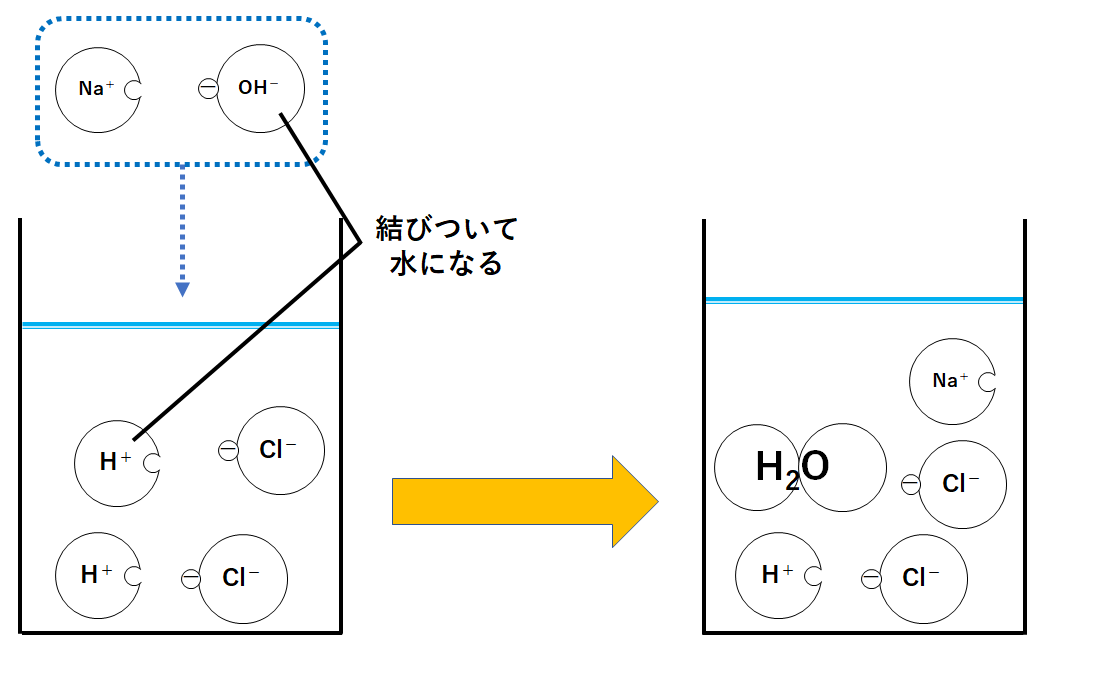
②水酸化ナトリウム水溶液を少し加えたとき
ここで水酸化ナトリウム水溶液を少し加えてみます。
水酸化ナトリウムは水溶液中で
NaCl → Na+ + Cl-
と電離しています。
いまナトリウムイオンNa+1個と塩化物イオンCl-1個のセットを加えたとしましょう。
ここでH+とOH-が結びついて水H2Oになります。(つまり中和が起こった。)
このときNa+とCl-が結びついて塩化ナトリウムNaClができる………ように思えます。
が、塩化ナトリウムNaClは電解質のため、電離したまま(Na+とCl-が結びつかないまま)存在してしまいます。
このとき、まだH+があるので溶液は酸性を示します。
つまりBTB溶液は黄色のまま(さっきよりはうすくなる)です。
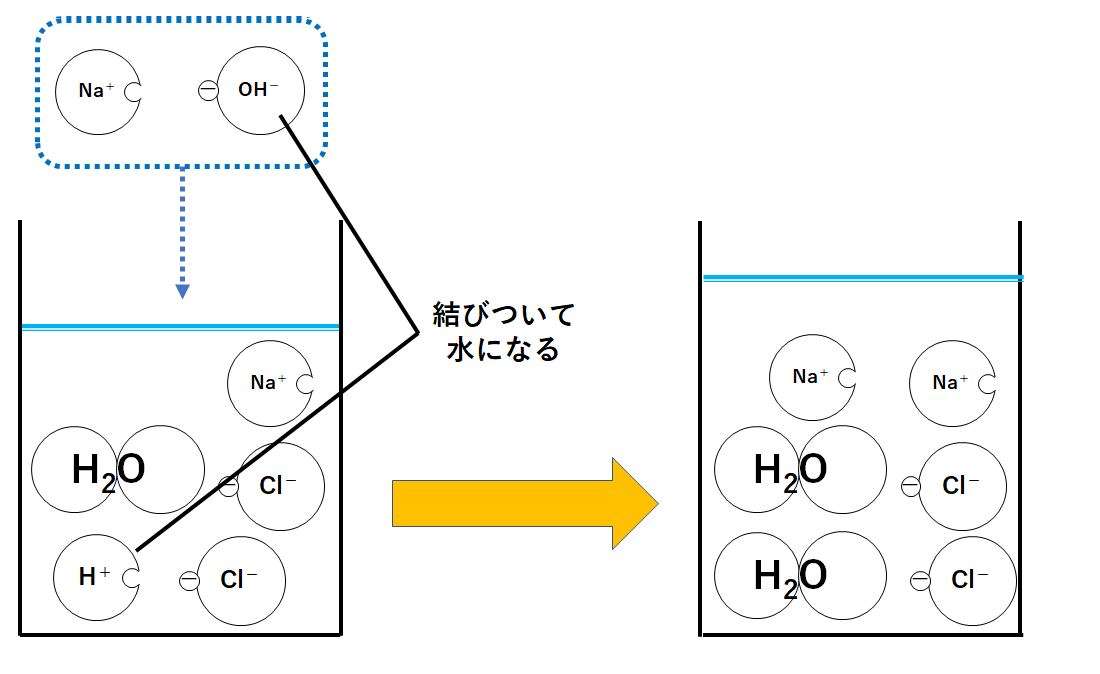
③水酸化ナトリウム水溶液をさらに加えたとき
ここにさらにNa+1個とCl-1個のセットを加えたとしましょう。
先ほどと同様、H+とOH-が結びついて水H2Oになります。(つまり中和が起こった。)
またNa+とCl-は結びつかないまま溶液中に存在します。
このとき、ビーカーの中にはH+がありません。
またOH-もありません。
つまり酸性でもアルカリ性でもない、中性というわけです。
よってBTB溶液は緑色になります。
④水酸化ナトリウム水溶液をもう一度加えたとき
そしてさらにNa+1個とCl-1個のセットを加えたとしましょう。
もう溶液にはH+が残っていません。
OH-は誰とも結びつかず、そのまま。
そのため、中和は起こりません。
またNa+とCl-も結びつかないまま溶液中に存在します。
このとき溶液にはOH-があります。
よって溶液はアルカリ性を示します。
BTB溶液は青色になるということです。
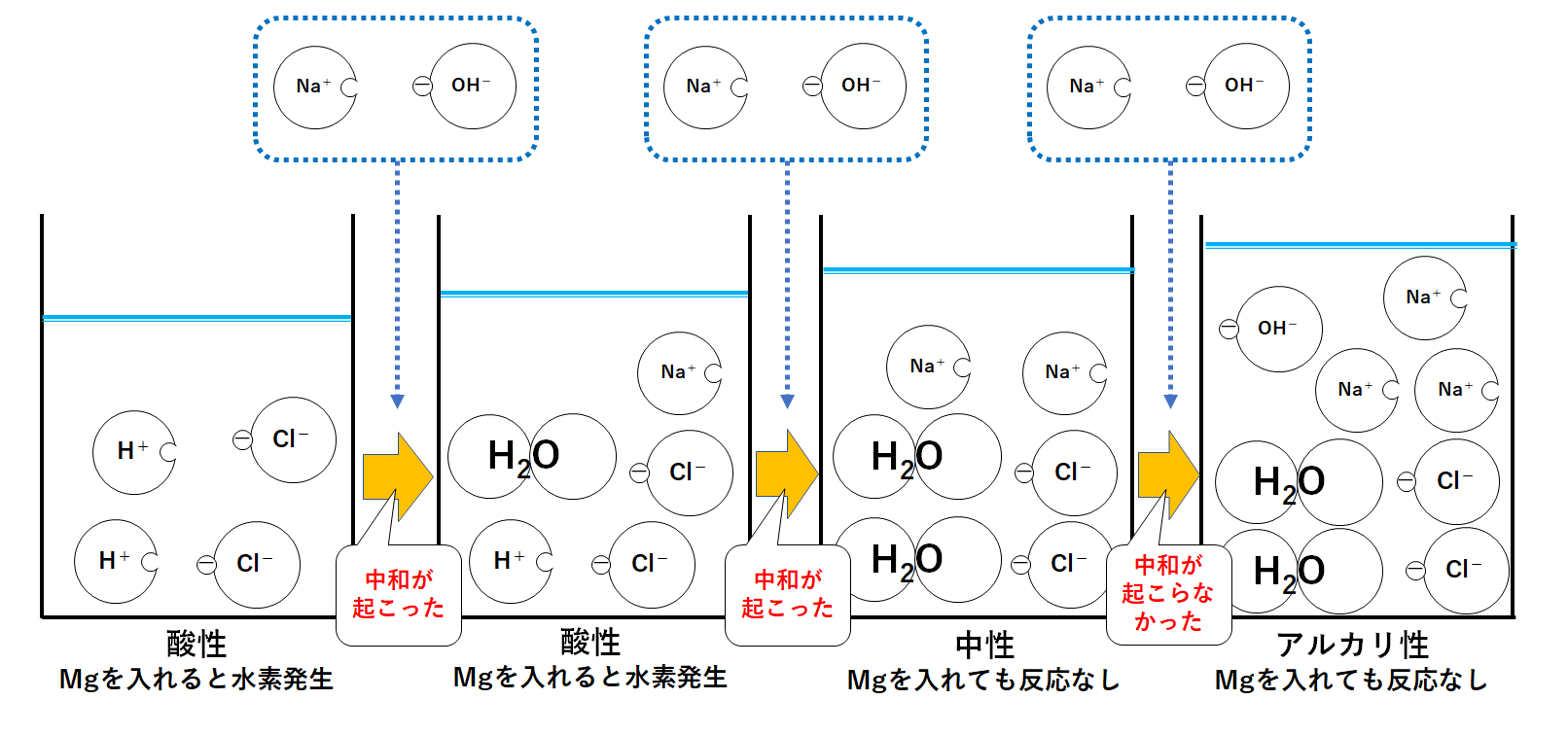
まとめ
それぞれのビーカーの液性は図の通り、酸性→中性→アルカリ性へと変化していきます。
また酸の性質として、
金属と反応して水素を発生させる
というものがあります。
よって左側2つのビーカーは酸性なのでマグネシウムなどの金属を入れると水素が発生します。
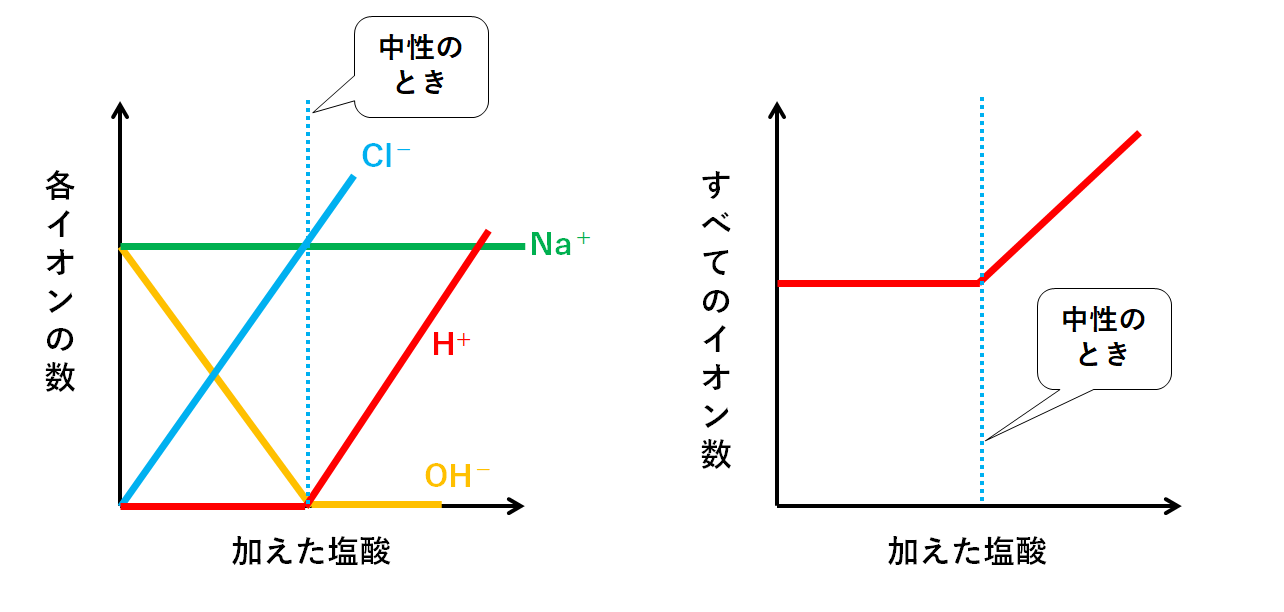
各イオンの数の変化
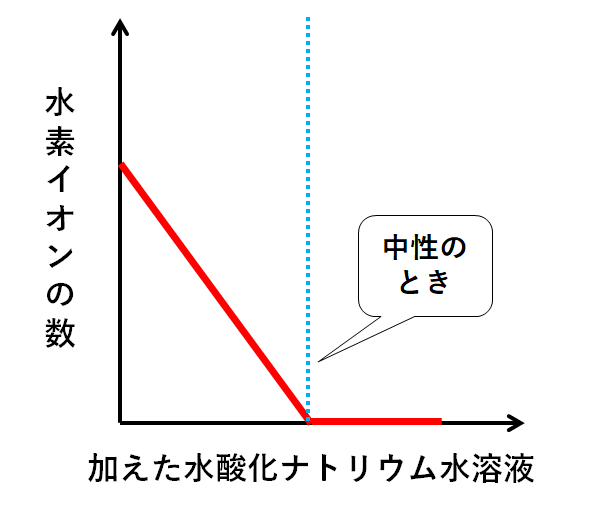
各イオンの数の変化をグラフにまとめてみましょう。
▼水素イオンH+
水酸化ナトリウム水溶液が加えられ、中和が起こるのでH+の数は減少していきます。(H2Oに変化していく)
▼塩化物イオンCl-
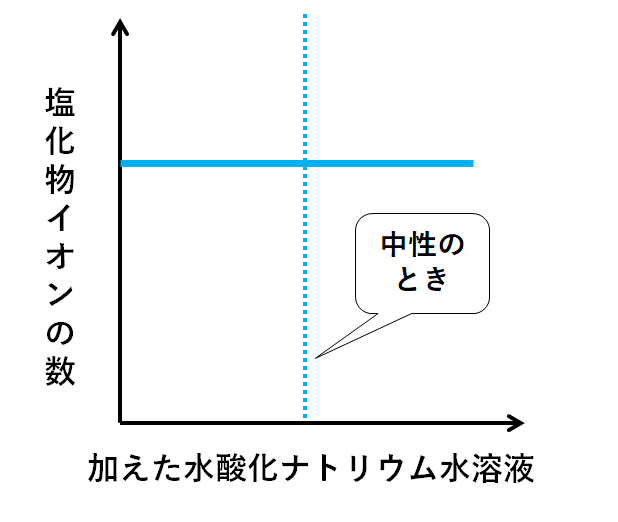
Cl-はNa+と結びついて塩化ナトリウムNaClになる………ように思えます。
しかし、塩化ナトリウムNaClは電解質のため、電離したまま(Na+とCl-は結びつかないまま)存在しています。
よって最初から最後まで数は変化しません。
▼ナトリウムイオンNa+
先ほどと同じで、Na+とCl-は結びつかないまま存在しています。
よって水酸化ナトリウム水溶液を加えていっても、ほかのイオンとも反応せず、そのままで液中に増えていきます。
▼水酸化物イオンOH-
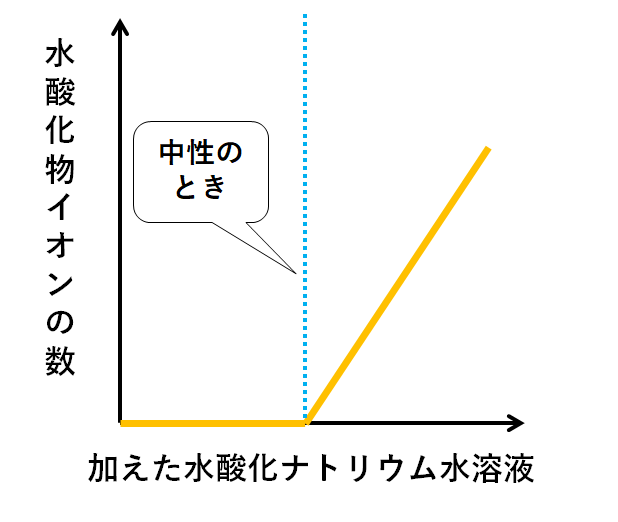
はじめはOH-を加えても、H+と反応してH2Oへと変化してしまいます。
中和に使われるのでビーカーには残りません。
ですがH+がなくなってからは、中和に使われることはないので増加していくのです。
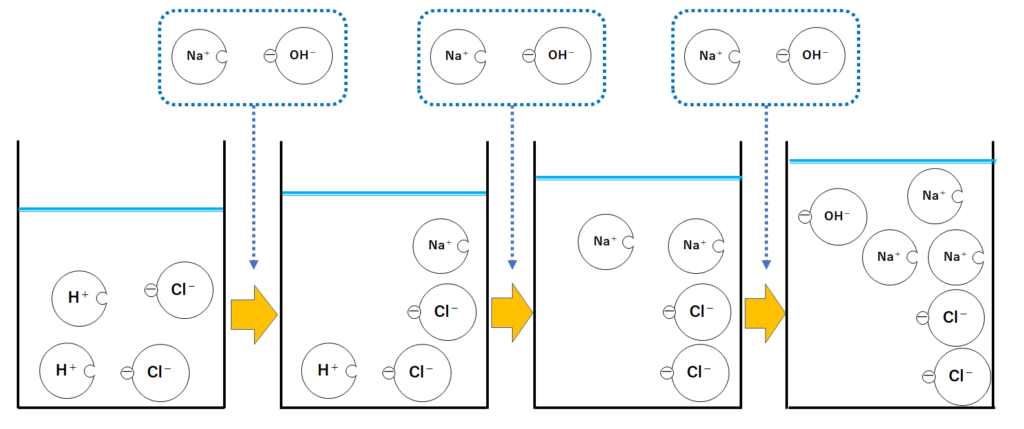
イオンの総数・電流
さきほどのまとめの図からH2Oのモデルのみを取り除きます。(↓の図)
ここからイオンの総数(種類問わずイオンの合計数)を見ると
4個→4個→4個→6個
と変化しています。
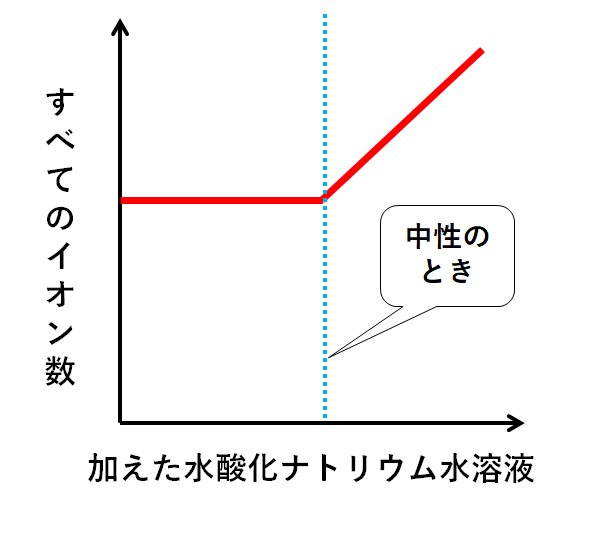
つまりグラフ化すると↓のようになります。
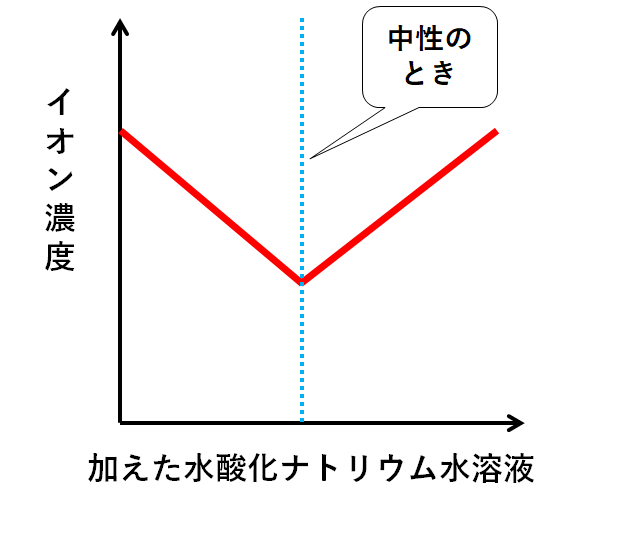
さらにイオンの濃度(水溶液全体に対してイオンが占める割合)をグラフ化すると↓のようになります。
それぞれの段階の溶液がどれくらい電流を通すか、というのはこのイオン濃度で決まります。
・イオン濃度が高い → 電流を通しやすい
・イオン濃度が低い → 電流を通しにくい
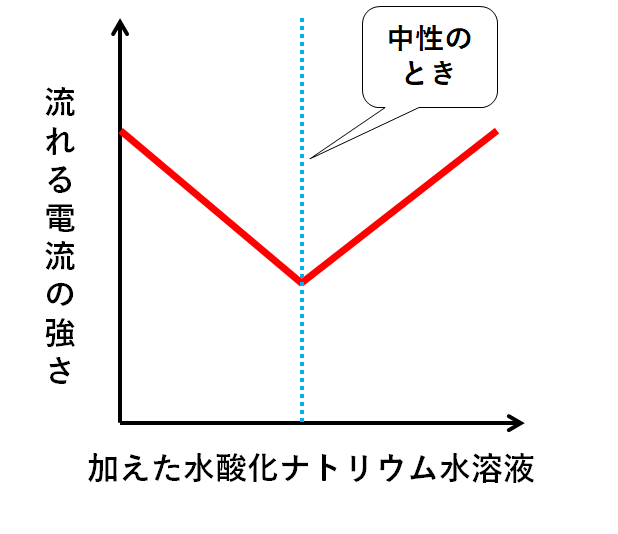
よって電流の大きさを表すグラフは↓のようになります。
中性に近いほど電流を通しにくいことになります。
しかしイオンがなくなることはないので、電流が流れないという状態になることはありません。
以上のグラフはとても重要です。
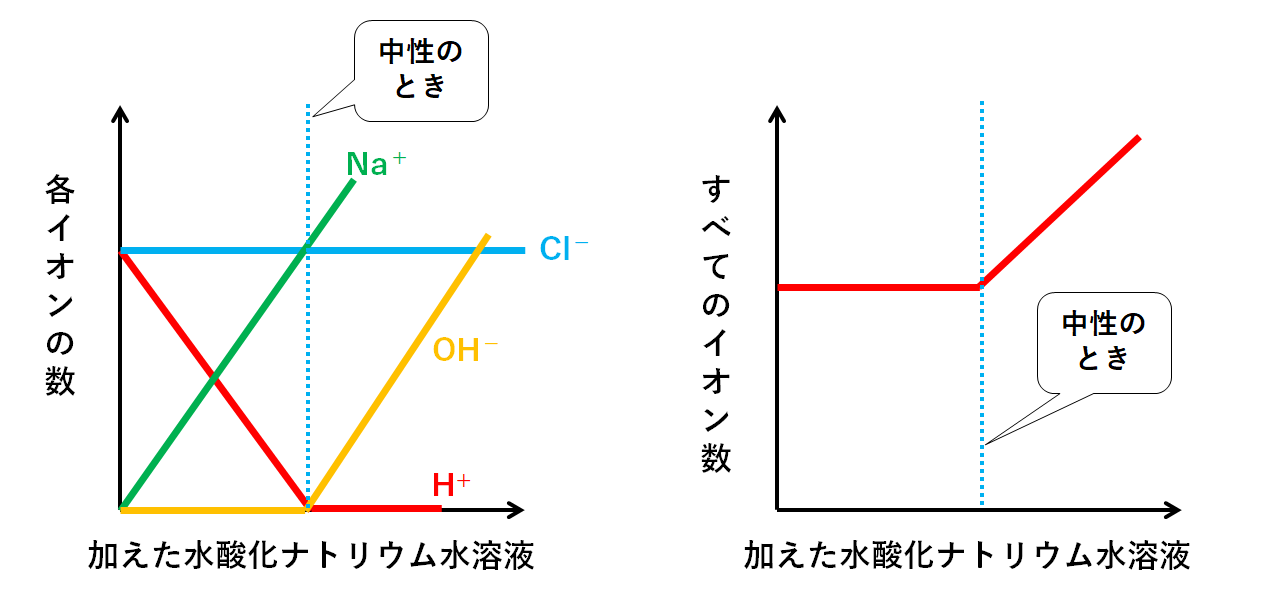
しかし、これは
「塩酸の入ったビーカーに水酸化ナトリウム水溶液を少しずつ加えていった」
という実験下でのグラフです。
もしも
「水酸化ナトリウム水溶液の入ったビーカーに塩酸を少しずつ加えていった」
ならば↓の図のようにグラフの様子も変わってしまいます。
グラフの形を丸覚えするのではなく、問題文の条件を見逃さないように気を付けながらグラフをイメージできるようになりましょう。




コメント(承認された場合のみ表示されます)
塩酸を加えるときになぜナトリウムイオンの数がかわらないのか分からなかったけど塩化ナトリウムになってもまたイオンになるということだったんですね!
水にとけにくい硫酸バリウムだともともとあったイオンの数は減っていきますよね?
中ボー様
コメントありがとうございます。
おっしゃる通りです。
硫酸バリウムの場合ですと、中性に近づくにつれイオン数は減少します。
そして中性でイオンは0個になってしまいます。
[…] 引用:中学理科 ポイントまとめと整理 https://chuugakurika.com/2018/02/28/1874/ […]
まじで助かりました!
レポートもサクサク進んで最高です!
とある私立中学校に通うK.T.様
コメントありがとうございます。
お役に立てて何よりです。
レポートがんばってくださいね。
Naclは電解質だから電離したままと言うのがよく分かりません😢教えて頂けますでしょうか?
理様
コメントありがとうございます。
NaClの性質として「水があると陽イオンNa+と塩化物イオンCl-に分かれる」という性質があります。
この現象を「電離」といい、「水に溶けて電離する物質」を電解質といいます。
塩酸と水酸化ナトリウム水溶液を混ぜると、水ができますよね。
またともに水溶液なので、もともとの水も存在しています。
塩酸と水酸化ナトリウム水溶液を混ぜると、水溶液中にはNa+とCl-が存在することになります。
仮にこれが結びついてNaClになったとしても、NaClは電離してしまうのでNa+とCl-に分かれてしまいます。
(というかもともと水がある状態だと、Na+とCl-は結びつこうとしない)
よってNa+とCl-のまま存在するのです。
この水溶液を加熱し水を蒸発させると塩化ナトリウムが出てきますが、
その場合どのタイミングで塩化物イオンとナトリウムイオンは結びついているのですか。
t様
コメントありがとうございます。
ご質問の件ですが、水溶液中においては、ナトリウムイオンや塩化物イオンは水分子に囲まれている状態です。
(高校化学で学習しますが、水分子の水素や酸素の部分にイオンが引き付けられている状態です)
水が蒸発により空気中へ出ていくと、ナトリウムイオンや塩化物イオンのまわりの水分子がなくなり、
ナトリウムイオンと塩化物イオンがたがいに引き合って(+の電気と-の電気であるので)、塩化ナトリウムとなります。
塩酸と水酸化カルシウムの式本当にあってますか?
反応前と反応後を比較すると原子の数があいません
OHが一つ足りないのと、Clが多くなっていませんか確認お願いします。
みかん様
コメントありがとうございます。
ここでは「化学反応式的な意味合い」はいったん除いて、
・カルシウムイオンと塩化物イオンが反応して塩化カルシウムができる
・水素イオンと水酸化物イオンが反応して水になる
ということだけでにフォーカスしたために、このような説明になりました。
確かに混乱を招いてしまいますね。
近いうちに修正しておきます。