水は特殊な性質を持つ物質です。
特に数多くの物質を溶かす性質を持っています。
なぜ水はものを溶かすのでしょうか。
そもそも「溶ける」とはどのような現象なのでしょうか。
このページでは中学段階でもある程度わかるようにそれを解説していきます。
1.電気陰性度
まず知っておきたいのが電気陰性度。
難しそう名称ですが、中身はシンプル。
原子核が電子を引き寄せる力の大きさを表します。
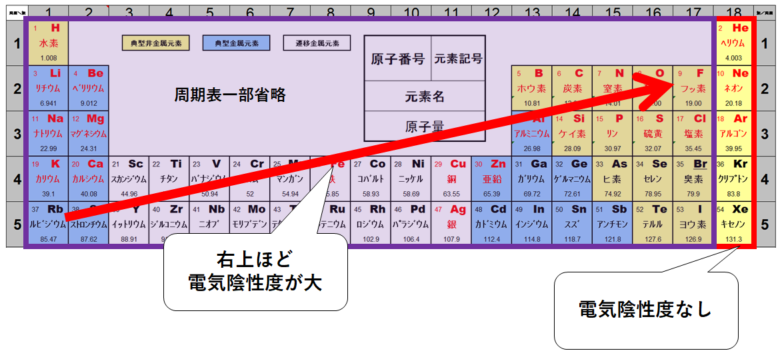
原子の種類によって電気陰性度は異なります。
一般に周期表の右上に行くほど大きくなります。(フッ素原子Fが最大)
2.極性
電気陰性度は原子の種類によって異なります。
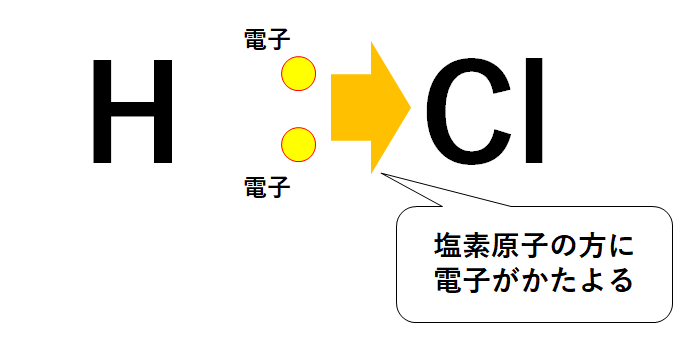
例えば塩化水素HCl。
塩化水素分子は塩素原子と水素原子がたがいに電子を共有して結びついています。
しかし塩素原子と水素原子では電気陰性度がちがいます。
電気陰性度の大小関係は 塩素原子Cl>水素原子H。
ということは共有している電子が塩素原子の方に強く引き寄せられています。
この結果、塩素原子は-の電気を多く持っている状態(つまり-にかたよる)になっています。
一方で水素原子は-の電気がはなれた状態(つまり+にかたよる)です。
このように、原子どうしの電気陰性度の差によって各原子が+または-にかたよります。
このようなかたよりを極性といいます。
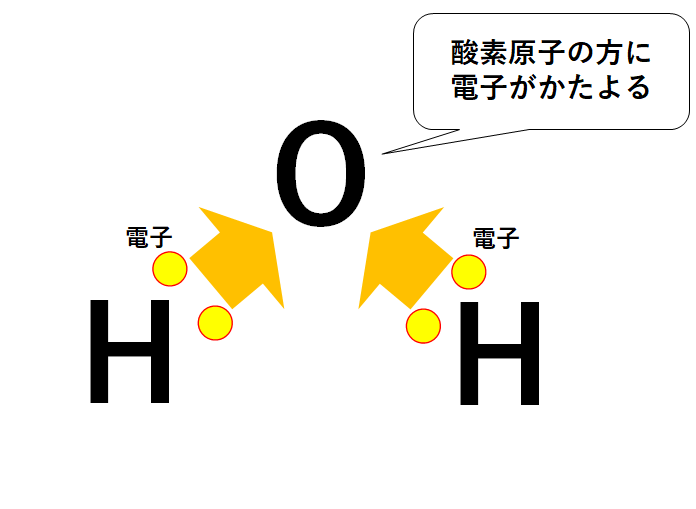
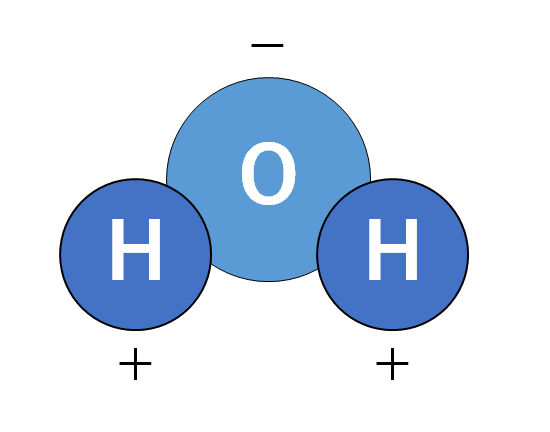
水分子にもこの極性が存在します。
水素原子Hと酸素原子Oの電気陰性度の大小関係は 酸素原子O>水素原子H。
つまり酸素原子が電子を強く引き寄せます。
よって酸素原子は-にかたより、水素原子は+にかたよります。
これが水にものが溶ける原因になります。
3.水に溶けるとは
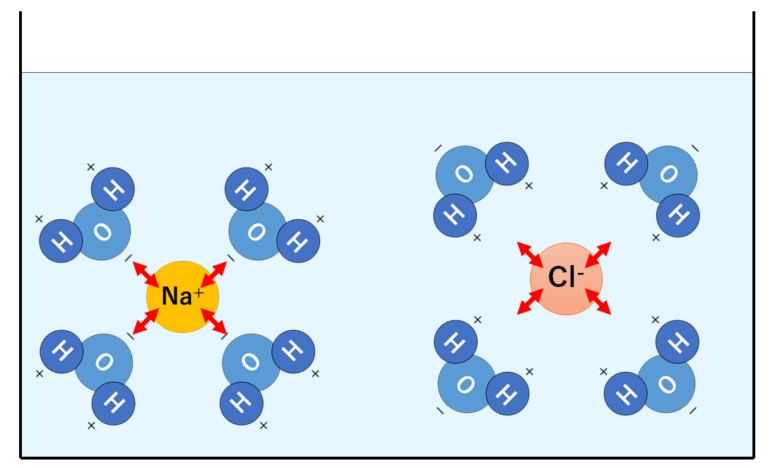
塩化ナトリウムNaClが水に溶けることを考えましょう。
塩化ナトリウムNaClはナトリウムイオンNa+と塩化物イオンCl-が結びついてできた物質です。
これを水に入れると・・・
水分子H2Oのうち水素原子Hは+にかたより、酸素原子Oは-にかたよっていました。
つまり酸素原子OはナトリウムイオンNa+を引き寄せます。
そして水素原子Hは塩化物イオンCl-を引き寄せます。
こうすることでナトリウムイオンNa+と塩化物イオンCl-は互いに引き離され、バラバラになります。
これが「溶けた」という状態です。
このように陽イオンと陰イオンが結びついているものは、水分子の中に存在する極性によって溶けていきます。
物質によって陽イオンと陰イオンの結びつきの強さが異なるので、「水に溶けやすい」「溶けにくい」のちがい、または結びつきがとても強ければ「水に溶けない」ものも存在します。
あるいは、分子内に極性が存在するものは、水分子によってバラバラに引き離されやすいため、溶けやすいと言えます。

コメント(承認された場合のみ表示されます)