このページでは「電離とは何か」「電離のようすを表す式」「電解質とは」について解説しています。
イオンの単元の学習を進めるには「イオンとは何か?」をきちんと理解しておく必要があります。
イオンについて知りたい人は→【イオンとは】←を確認してみてください。
動画による解説はこちら↓↓↓
https://youtu.be/beLmR0or3Jc
チャンネル登録はこちらから↓↓↓
1.イオンどうしの結びつき
陽イオンは+の電気を、陰イオンは-の電気を帯びています。
磁石のN極とS極のように、+の電気と-の電気は互いに引き合います。
このように陽イオンと陰イオンがたがいに引き合ってできている物質があります。
例えば塩化ナトリウム。
化学式はNaCl。
化学式だけを見ればナトリウムNaと塩素Clが結びついている、ように見えます。
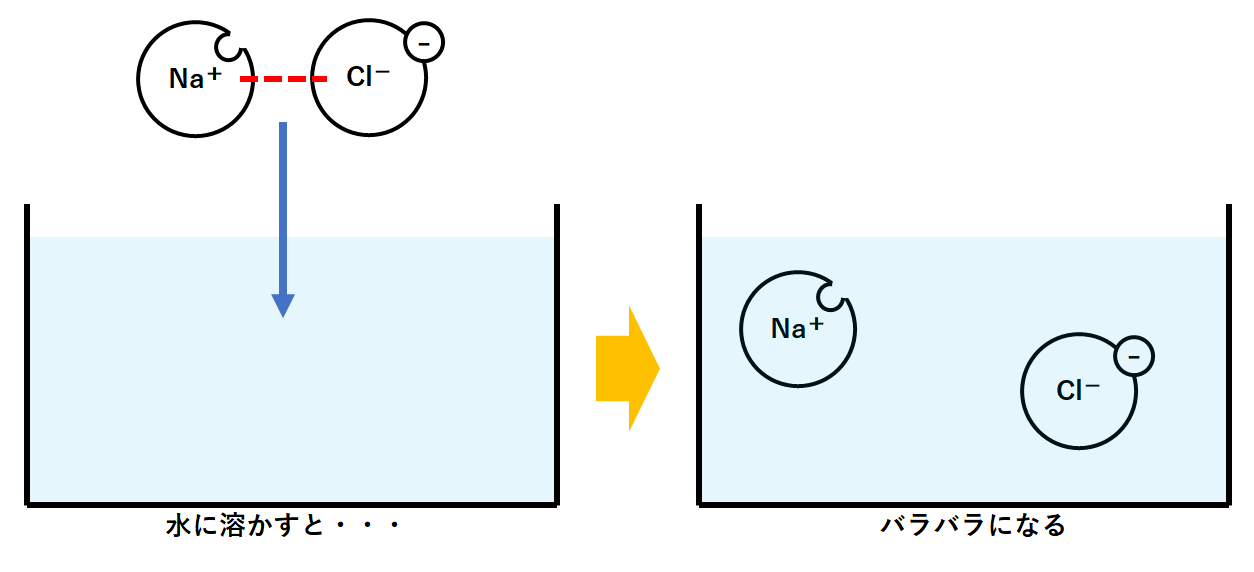
実際はナトリウムイオンNa+と塩化物イオンCl-が引き合って結びついています。(↓の図)
このように陽イオンと陰イオンが結びついてできた物質の一部は・・・
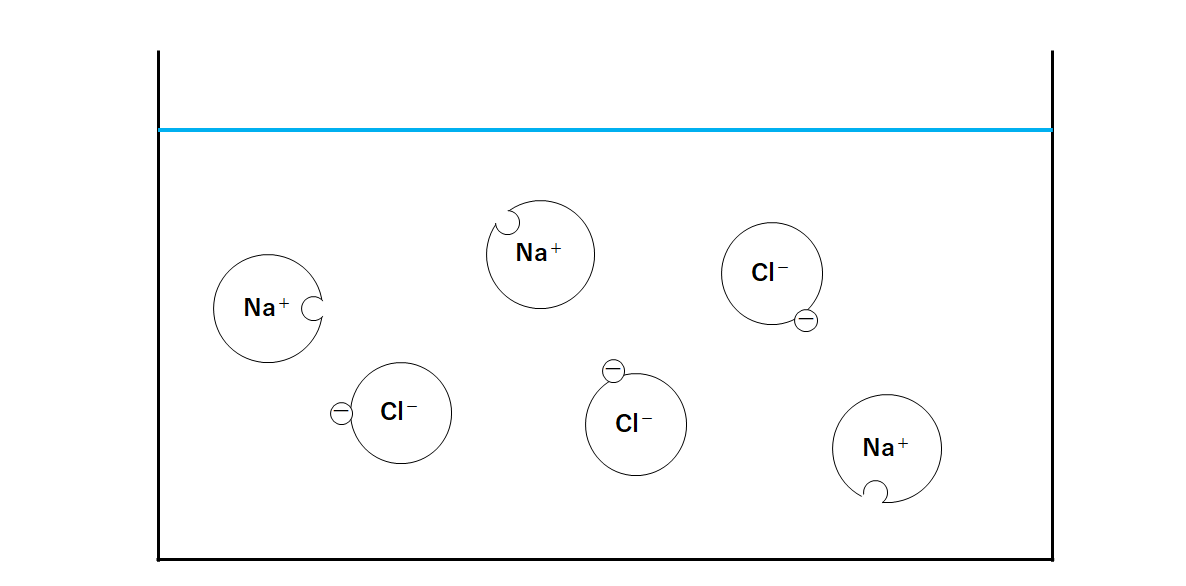
水に溶けると、その結びつきがなくなります。
そして陽イオンと陰イオンがバラバラになります。(↓の図)
※水にはイオン同士の結びつきを引き離す力があります。
このように水に溶けて、陽イオンと陰イオンの結びつきがなくなり、バラバラになる現象を電離といいます。
また水に溶けて電離する(=陽イオンと陰イオンに分かれる)物質を電解質といいます。
一方で水に溶けても電離はしない物質は非電解質といいます。
陽イオンと陰イオンが結びついてできている物質を水に溶かす。
そのときに陽イオンと陰イオンに分かれること。
※イオン同士が結びついている物質が融解(固体から液体に変化)しても電離する。
電離する物質のこと。
つまり水に溶けて陽イオンと陰イオンに分かれる物質のこと。
電解質の水溶液は電流を通すという性質がある。
水に溶けても電離しない物質。
非電解質の水溶液は電気を通さない。
例)砂糖・エタノール(有機物)
※この2つは頻出。必ず覚えましょう。
※ただしイオン同士が結びついている物質全てが水に溶けるわけではありません。
硫酸バリウムや塩化銀などは、イオン同士の結びつきが非常に強いので、水でその結びつきを引き離すことができません。(つまり水に溶けない)
これらは電解質でも非電解質でもありません。
よくある間違い
よくあるひっかけ問題を1つ紹介します。
この文章は○ or ×?
(答)
固体の塩化ナトリウム自体は電気を通しません。
塩化ナトリウムの溶けた水溶液が電気を通すのです。
つまり×です。
2.電離式
さまざまな物質で電離の様子を見てみましょう。
例① 塩化ナトリウム(NaCl)の場合
塩化ナトリウムは化学式NaClです。
見た目は↓のように、ナトリウム原子Naと塩素原子Clが結びついていると思えますが・・・
実際はナトリウムイオンと塩化物イオンが結びついています。(↓の図)
これらは水に溶かすことで↓のようになります。
NaCl → Na+ と Cl-
のように電離しました。
この「と」を「+」に書き換えます。
NaCl → Na+ + Cl-
このような式を電離式といいます。
「左辺:電離前→右辺:電離後」として、化学式やイオン式をつかって表します。
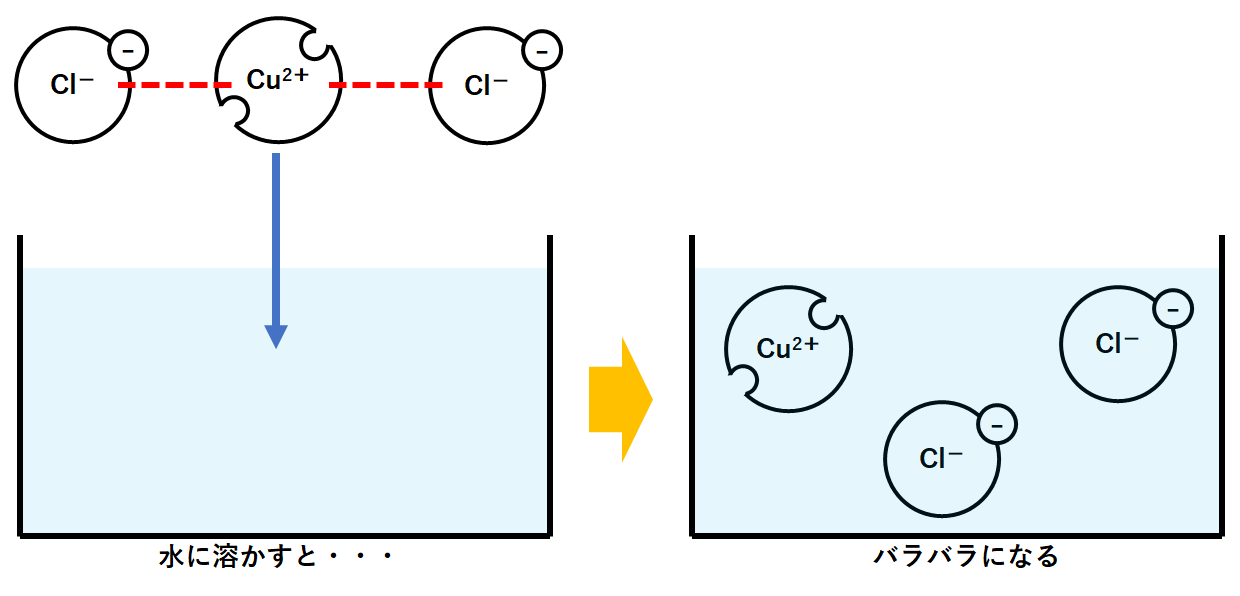
例② 塩化銅CuCl2の場合
塩化銅は化学式CuCl2です。
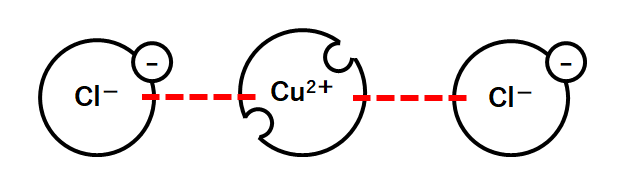
化学式を見ると、銅原子Cu1つと塩素原子Clが2つ結びついているように見えますが・・・
実際は、銅イオンCu2+と塩化物イオンCl-2つが結びついてできています。(↓の図)
これを水に溶かすと、バラバラになってしまいます。(↓の図)
このように、塩化銅は銅イオン1つと塩化物イオン2つに電離します。
これを化学式やイオン式をつかって表すと
CuCl2 → Cu2+ と 2つのCl-
のように変化(電離)しています。
「と」を「+」に書き換えて
CuCl2 → Cu2+ + 2Cl-
これが塩化銅の電離式です。
電離式を書くポイント
電離とは、物質が陽イオンと陰イオンに分かれることなので
物質 → 陽イオン + 陰イオン
という形の式になります。
また
左辺と右辺で各元素の個数が同じである
必要があります。
例えば
CuCl2 → Cu2+ + Cl-
という式は誤りです。
左辺のCl原子は2個。
右辺のCl-は1個。
と個数が異なるためです。
左辺と右辺で各元素の個数を同じになるように書きましょう。
3.代表的な電離式
まずはイオン式を必ず暗記しましょう。
そのうえで次の電離式が書けるようになりましょう。
*の印のものは余裕があれば書けるように。



コメント(承認された場合のみ表示されます)
塩化ナトリウムの場合、水に溶かすと、Na+とCL-に別れますが、水を蒸発させると、またくっついてNaClとなってでてくるのですか。また、水は非電解質なのですか?中和の実験で、塩酸に水酸化ナトリウムをいれていくと、H+とOH-は水の中でもくっつくのはなんでなのですか?
理科わかりません様
コメントありがとうございます。
>塩化ナトリウムの場合、水に溶かすと、Na+とCL-に別れますが、水を蒸発させると、またくっついてNaClとなってでてくるのですか。
その通りです。水分を蒸発させると塩化ナトリウムの結晶が出てきます。
>水は非電解質なのですか?
水は電解質でも非電解質でもありません。
電解質かどうかは「水に溶ける物質のうち、電離するかどうか」なので、水そのものはどちらでもありません。
ただ、水自体はごくごくわずかに電離します。ただしわずかです。
>中和の実験で、塩酸に水酸化ナトリウムをいれていくと、H+とOH-は水の中でもくっつくのはなんでなのですか?
水素イオンは+の電気、水酸化物イオンは-の電気を帯びているため、結び付きます。
塩酸は電解質ですか?塩化水素と水の混合物である塩酸は電解質でないと思うので知りたいです。
LK様
コメントありがとうございます。
電解質は水に溶けると電離する物質なので、塩酸は電解質とは言えないと思います。