1.溶解度に関する計算
溶解度に関する計算問題はバリエーションが非常に多いため、解法パターンの暗記では到底追いつきません。
しかし最低限覚えておくべき解法というのもあります。
ここではそれを紹介したいと思います。
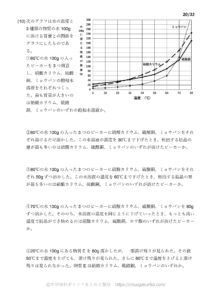
以下の例題ではすべて溶質をXという物質であるとし、各温度における水100gに溶ける量(溶解度)が↓の表のようになっているとします。
例題1
60℃の水にXを溶けるだけ溶かし、飽和水溶液をつくった。質量パーセント濃度はいくらか。
小数第2位を四捨五入して答えよ。
(答)
水の量が指定されていません。
じゃあ求められないのか?というとそうではありません。
この場合は水の量を100gと仮定して解きましょう。
ちなみに
$$質量パーセント濃度=\frac{溶質(g)}{水溶液全体(g)}×100$$
で求められます。
60℃の水100gにはXが130gが溶けるので
$$\frac{130g}{100g+130g}×100=\frac{130}{230}×100=56.52・・・=56.5%$$
となります。
よって56.5%が正解です。
しかし水の量を勝手に100gにしたけれど、200gなら違うんじゃないの?と思う人もいるかもしれません。
もし水200gだったら、と仮定して計算してみましょう。
60℃の水200gにはXが260gが溶けるので
$$\frac{260g}{200g+260g}×100=\frac{260}{460}×100=\frac{130}{230}×100=56.52・・・=56.5%$$
と結局同じ計算をすることになります。
つまり飽和水溶液の濃度は水の量に関係なく(温度によって)一定となっています。
例題2
30℃の水にXを溶けるだけ溶かし、飽和水溶液200gをつくった。この飽和水溶液から水を50g蒸発させると何gのXが結晶として現れるか。
(答)
蒸発させた水50gに溶けていたXが結晶として現れます。
すなわち、(蒸発させる)50gの水に溶けるXの量を求めればよいのです。
現れる結晶の質量をx(g)とすると
$$100g:39g=50g:x(g)$$
$$x=19.5g$$
よって19.5gが正解です。
例題3
60℃の水にXを溶けるだけ溶かし、飽和水溶液230gをつくった。
(1) この中に溶けているXは何gか。
(2) この水溶液の温度を30℃まで下げたとき、生じる結晶は何gか。
(答)
(1)
できるだけきちんと状況を整理しましょう。
いま水の量がわかりませんが、表より
60℃の水100gにXは130gまで溶ける(60℃の飽和水溶液が230g)
ことがわかります。
よって飽和水溶液230gにはXは130g溶けていることがわかります。
(2)
(1)より、いまの水の量は100gです。
表より
30℃の水100gにXは39gまで溶ける
ことがわかります。
もともと溶けていたXは130gなので、生じる結晶は
$$130-39=91g$$
となります。
よって91gが正解です。
例題4
60℃の水にXを溶けるだけ溶かし、飽和水溶液460gをつくった。
(1)この中に溶けているXは何gか。
(2)この水溶液の温度を30℃まで下げたとき、生じる結晶は何gか。
(答)
(1)
いま水の量がわかりませんが、表より
60℃の水100gにXは130gまで溶ける(60℃の飽和水溶液が230g)
ということがわかります。
つまり飽和水溶液230gにはXが130g溶けているということです。
では飽和水溶液460gに溶けているXの量をy(g)とすると
$$230 g:130 g=460 g:y (g)$$
$$y=260g$$
(「飽和水溶液の量:溶けているXの量」という比例式)
よって260gが正解です。
(2)
(1)より水は
460-260=200g
あることがわかります。
表より
30℃の水100gにXは39gまで溶ける
ことがわかります。
よって
30℃の水200gにはXは 39×2=78g まで溶ける
ことがわかります。
よって生じる結晶は
$$260g-78g=182g$$
となります。
よって182gが正解です。
ここで例題3と例題4を振り返りましょう。
例題3では
60℃のXの飽和水溶液230g(水:100g X:130g)
→30℃まで下げたときの結晶は91g
例題4では
60℃のXの飽和水溶液460g(水:200g X:260g)
→30℃まで下げたときの結晶は182g
となっていました。
飽和水溶液の量と生じる結晶の量が比例しています。
この関係を利用して次の例題5を見てみましょう。
例題5
60℃の水にXを溶けるだけ溶かし、飽和水溶液115gをつくった。
この水溶液の温度を30℃まで下げたとき、生じる結晶は何gか。
(答)
例題3や4より
60℃のXの飽和水溶液230g(水:100g X:130g)
→30℃まで下げたときの結晶は91g
であることがわかっています。
求める結晶をz(g)として、
飽和水溶液の量と生じる結晶の量が比例することを利用すると
$$230g:91g=115g:z(g)$$
$$z=45.5g$$
となります。
(「飽和水溶液の量:結晶の量」という比例式)
つまり45.5gの結晶が生じることになります。
例題6
50℃の水にXを溶けるだけ溶かし、飽和水溶液100gをつくった。
この水溶液の温度を10℃まで下げたとき、生じる結晶は何gか。
(答)
まず表より
50℃の水100gにはXが90gまで溶ける(50℃の飽和水溶液190gができる)
10℃の水100gにはXが13gまで溶ける
ことがわかります。
この数字から50℃の飽和水溶液190gを10℃まで下げると
$$90-13=77g$$
の結晶が生じることがわかります。
つまり
50℃の飽和水溶液190g
→10℃まで下げると77gの結晶
ということです。
いまの問題では
50℃の飽和水溶液100g
→10℃まで下げると??gの結晶
を考えさせていますね。
w(g)の結晶が現れるとすると
$$190g:77g=100g:w(g)$$
$$w=40.52・・・≒40.5g$$
(「飽和水溶液の量:結晶の量」という比例式)
よって40.5gの結晶が現れることがわかります。
こちらもどうぞ
溶解度の計算問題をつくりました。
こちらにて販売中です。(PDFファイルのダウンロード販売です)
1ファイルで220円です。よければどうぞ。

コメント(承認された場合のみ表示されます)
5/29にこのページの問題に関してご質問をくださった方
メールアドレスの設定のためか、こちらのメールが返送されます。
こちらに質問の回答をのせておきます。
30℃での水100gに溶ける量は表から39gです。
では水50gに溶ける量をx(g)とすると
100g:39g=50g:x(g)
という比例式になります。
「水の量:溶ける物質の量」という順の比例式を作っているということです。
飽和水溶液200gから50g分の水を蒸発させると、その蒸発させる50gの水に溶けていた物質が結晶となって出てきます。
そのため水50gに何gの物質が溶けていたか、を求めています。
とてもわかり易いです!
くま様
コメントありがとうございます。
お役に立てたなら幸いです。
またよければご利用ください。