このページでは入試で問われそうなさまざまな気体の性質をまとめています。
発展的な内容も含まれています。(*の印がついています)
中1向けの内容は→【気体の性質】←を参考に。
1.酸素
≪発生方法≫
①うすい過酸化水素水(オキシドール)+二酸化マンガン
※二酸化マンガンは過酸化水素水から酸素が発生するのを助けています。
※二酸化マンガンのように、自分自身は反応しないが周りの反応を助ける物質を触媒といいます。
※二酸化マンガンの代わりの触媒としてジャガイモやダイコンおろしなども使用できます。
*化学反応式:2H2O2 → 2H2O + O2
②酸化銀を加熱する
※酸化銀の分解(熱分解)という化学変化です。
化学反応式:2Ag2O → 4Ag+O2
③水に電気を通す
※陽極に酸素、陰極に水素が発生。
※水は電気を通しにくいので水酸化ナトリウムやうすい硫酸を加えます。
化学反応式:2H2O → 2H2+O2
≪性質≫
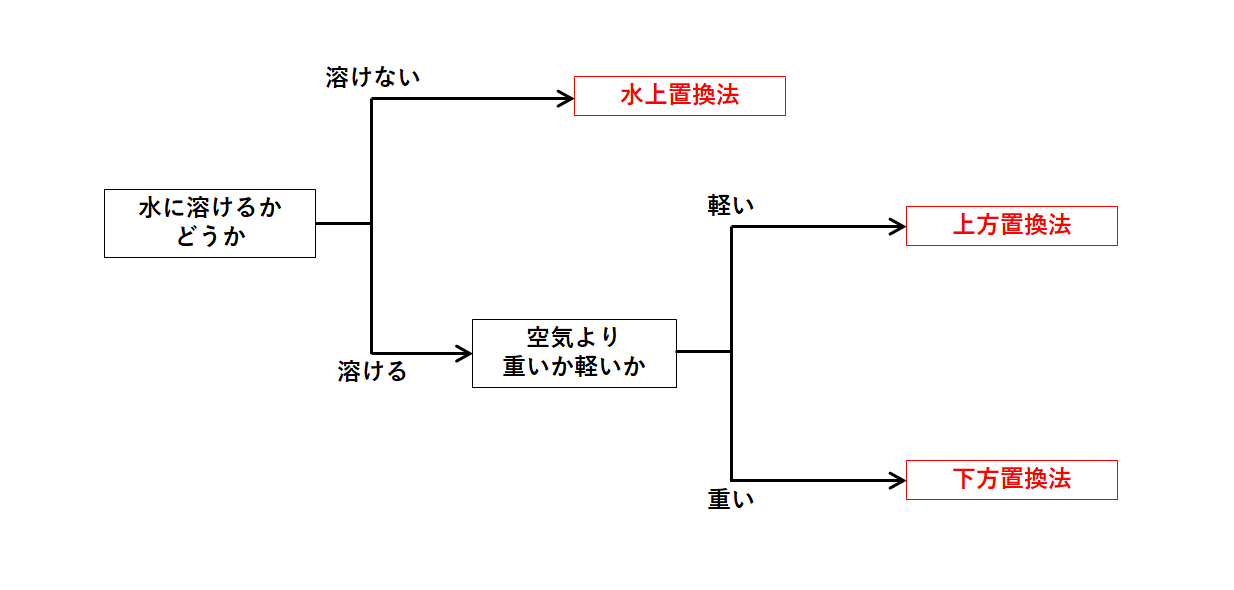
・水に溶けにくい。
→水上置換法で集める。
・空気より少し重い。
・ものが燃えるのを助ける働きがある。(助燃性)
※酸素がなければものは燃えません。
・火のついた線香を近づけると激しく燃える。
※「火のついたマッチ」では行わないので注意!
・空気中の約21%を占める。
・*酸素に紫外線を当てるとオゾンO3に変化する。
→*化学反応式:3O2 →2O3
・動植物が呼吸で使用する気体である。
呼吸・・・酸素+栄養分→エネルギー+二酸化炭素+水
2.二酸化炭素
≪発生方法≫
①石灰石+うすい塩酸
※石灰石の代わりに卵の殻や貝殻でもOKです。
※これらの主成分はすべて炭酸カルシウムCaCO3。
*化学反応式:CaCO3 + 2HCl → CaCl2 + H2O + CO2
②炭酸水素ナトリウム+うすい塩酸
※「炭酸○○+うすい塩酸」の組み合わせはすべて二酸化炭素発生と覚えましょう。
*化学反応式:NaHCO3 + HCl → NaCl + H2O + CO2
③炭酸ナトリウム+うすい塩酸
※「炭酸○○+うすい塩酸」の組み合わせはすべて二酸化炭素発生と覚えましょう。
*化学反応式:Na2CO3 + 2HCl → 2NaCl + H2O + CO2
④炭酸水素ナトリウムの加熱
※分解(特に熱分解)という反応です。
化学反応式:2NaHCO3 → Na2CO3 + H2O + CO2
⑤炭素の完全燃焼
化学反応式:C + O2 → CO2
⑥有機物の燃焼
有機物とは炭素原子を含む物質のこと。
そのため酸化(燃焼)すると二酸化炭素が発生します。
≪性質≫
・水に少し溶ける。
・空気より重い。
→水上置換法または下方置換法で集める。
・石灰水に通すと石灰水が白くにごる。
・水に溶けると(弱い)酸性を示す。
※その水溶液を 炭酸水 H2CO3 といいます。
・地球温暖化の原因である温室効果ガスの1つ。
・冷えて固体になったものをドライアイスという。
・植物が光合成で使用する気体である。
光合成・・・二酸化炭素+水+光のエネルギー→デンプン+酸素
3.水素
≪発生方法≫
①金属+酸(うすい塩酸や硫酸・硝酸など)
※金属でも金・銀・銅は不可。
※主にマグネシウム・アルミニウム・亜鉛・鉄などがよく出てくる。
②*一部の金属+アルカリ
※一部の金属とはアルミニウム・亜鉛。
※これらの金属は、酸・アルカリの両方と反応するため、両性元素と呼ばれる。
③水の電気分解
※陽極に酸素、陰極に水素が発生。
※水は電気を通しにくいので水酸化ナトリウムやうすい硫酸を加えます。
化学反応式:2H2O → 2H2 + O2
④塩酸の電気分解
※陽極に塩素、陰極に水素が発生。
化学反応式:2HCl → H2 + Cl2
≪性質≫
・水に溶けにくい。
→水上置換法で集める。
・マッチの火を近づけると音を立てて燃えて水ができる。(可燃性)
※「線香の火」では行わないので注意!
→ 化学反応式:2H2 + O2 → 2H2O
・気体の中で最も軽い(密度が小さい)。
・燃料電池の燃料として用いられる。
→ 化学反応式:2H2 + O2 → 2H2O
4.アンモニア
≪発生方法≫
①塩化アンモニウム+水酸化カルシウム(水酸化バリウム)
※代表的な吸熱反応。
化学反応式:2NH4Cl+Ca(OH)2→CaCl2+2H2O+2NH3
②アンモニア水を加熱する
③*窒素と水素の化合
※ハーバーボッシュ法と呼ばれる。
化学反応式:N2 + 3H2 → 2NH3
≪性質≫
・水によく溶ける。
・空気より軽い。
→上方置換法で集める。
・水に溶けると(弱い)アルカリ性を示す。
・刺激臭がある。
※においをかぐときは鼻を近づけすぎず、手であおぐようにしてかぎます。
・有毒である。
※そのため人体の中では、肝臓にて尿素につくりかえられる。
・*塩酸や塩化水素を近づけると白煙(正体は塩化アンモニウム)が生じる。
→ 化学反応式:NH3 + HCl → NH4Cl
・*アンモニアを原料として 硝酸 HNO3 がつくられる。
・肥料の原料ともなる。
5.窒素
≪発生方法≫
・*液体空気を加熱する。
※沸点のちがいを利用した蒸留。
≪性質≫
・水にとけにくい。
・空気より少し軽い。
・ほかの気体と反応しにくい。
※そのためお菓子の袋などに入っています。中身を変化させることなく保存するできるため。
・空気中の78%を占める。
・窒素原子はタンパク質や窒素肥料などに含まれ、重要な元素。
6.塩素
≪発生方法≫
①塩酸の電気分解
※陽極に塩素、陰極に水素が発生。
化学反応式:2HCl → H2 + Cl2
②塩化銅水溶液の電気分解
※陽極に塩素、陰極に銅が生成。
化学反応式:CuCl2 → Cu + Cl2
③*食塩水の電気分解
※陽極に塩素、陰極に水素が発生。
化学反応式:2HCl → H2 + Cl2
≪性質≫
・水に溶けやすい。
※そのため、電気分解をしても集まりにくい。
・空気より重い。
・黄緑色をしている。
・プールの消毒のようなにおいがする(刺激臭)。
・脱色作用がある。
※そのため、色のついたインクを近づけるとインクが無色になります。
・*水に溶けると酸性を示す。
7.塩化水素
≪発生方法≫
・*水素と塩素の化合
化学反応式:H2 + Cl2 → 2HCl
≪性質≫
・水に溶ける。
・空気より重い。
・塩化水素が水に溶けた水溶液を塩酸と呼ぶ。
※塩酸は強い酸性を示し、金属と反応して水素を発生させる。
・刺激臭がある。
・*アンモニアと反応して白煙(正体は塩化アンモニウム)が生じる。
→ 化学反応式:NH3 + HCl → NH4Cl
8.その他の気体
■*一酸化炭素 CO
・炭素が不完全燃焼したときに発生。
→その化学反応式:2C + O2 → 2CO
・有毒な気体。
※火事での死因の多くは「一酸化炭素中毒」によるものと言われます。
■*二酸化窒素 NO2
・赤褐色の気体。
・有毒。
・酸性雨の原因。
■*二酸化硫黄 SO2
・刺激臭がある。
・有毒。
・酸性雨の原因。
・硫酸や肥料の原料。
■硫化水素 H2S
・硫化鉄とうすい塩酸の反応によって生じる。
→*その化学反応式:FeS + 2HCl → H2S + FeCl2
・卵の腐ったようなにおい(腐卵臭)がする。
・有毒。
・無色。(有色と勘違いしやすい)
■メタン CH4
・有機物なので燃焼すると二酸化炭素と水ができる。
→*その化学反応式:CH4 + 2O2 → CO2 + 2H2O
・天然ガスの一種。
・温室効果がある。(地球温暖化の原因)

コメント(承認された場合のみ表示されます)