このページでは「溶解度とは何か」「溶解度曲線の見方」「再結晶の考え方」について解説しています。
動画による解説は↓↓↓
チャンネル登録はこちらから↓↓↓
1.溶解度
(水100gに最大何gまでその物質を溶かすことができるか?ということ)
その値は物質によって異なる。
固体の場合、水温が高いほど溶けやすい。気体の場合、水温が高いほど溶けにくい。
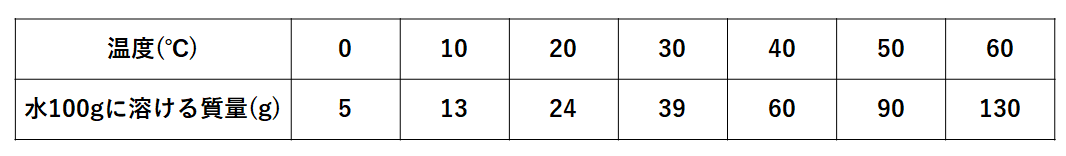
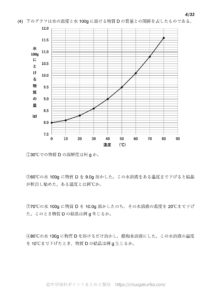
例.ある物質Xの溶解度
次の表はある物質Xの溶解度を表しています。
先ほど書いた通り、水温が高くなるほど溶けやすくなっています。
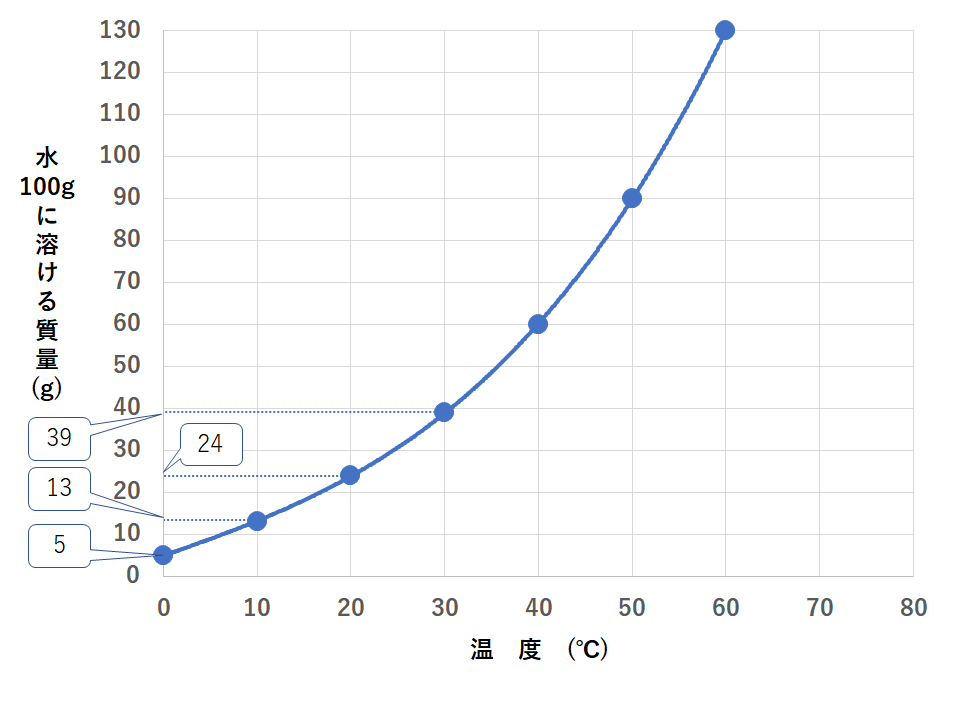
これをグラフ化したものを溶解度曲線と言います。
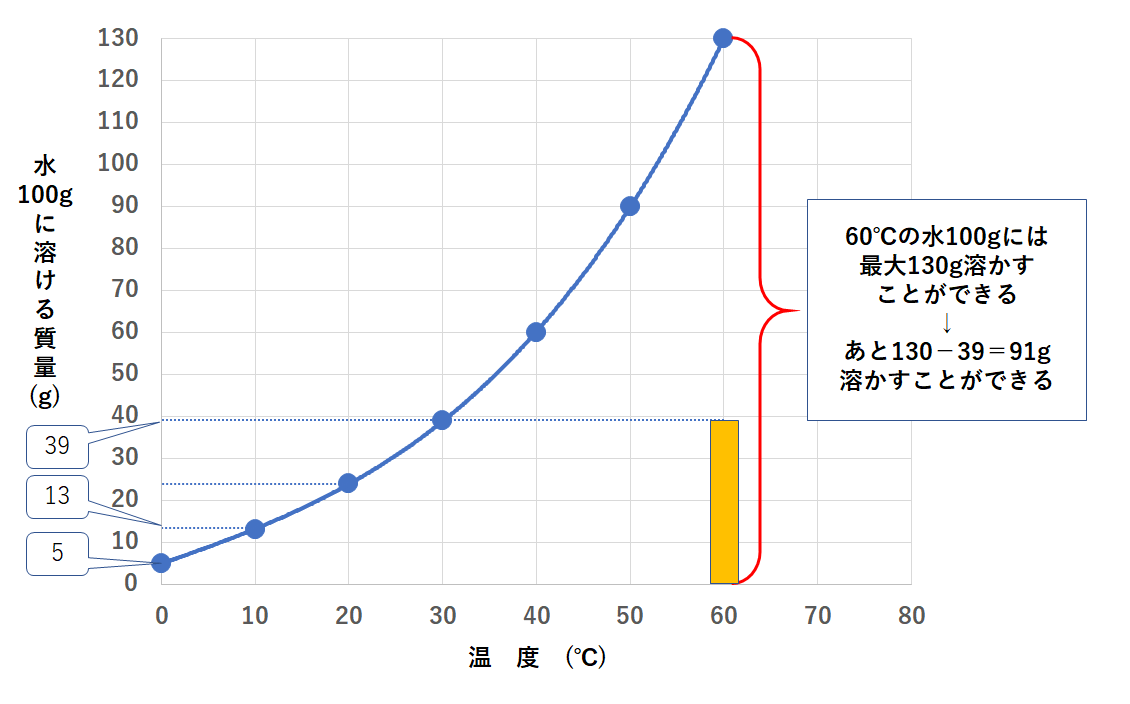
↓のグラフはこの物質Xの溶解度曲線です。
ここで
60℃の水100gに物質Xを39g溶かした
ときのことを考えましょう。
①60℃のとき
60℃では水100gに物質Xを130gまで溶かすことができます。
そしていま水100gに物質Xを39g溶かしていますので、まだ物質Xを加えても溶かすことができます。
あと 130-39=91g溶かすことができます。
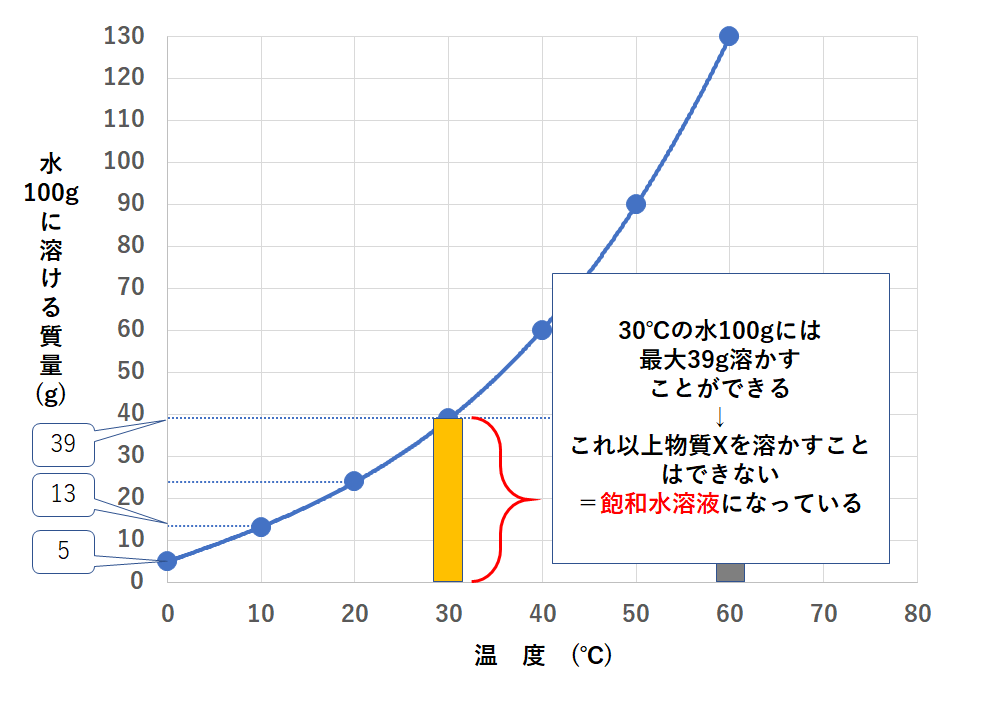
②30℃まで下げたとき
30℃では水100gに物質Xを39gまで溶かすことができます。
いま物質Xを39g溶かしていました。
つまりこれ以上物質Xを加えても、一切溶けることはありません。
このようにこれ以上物質を溶かすことができない水溶液を飽和水溶液と言います。
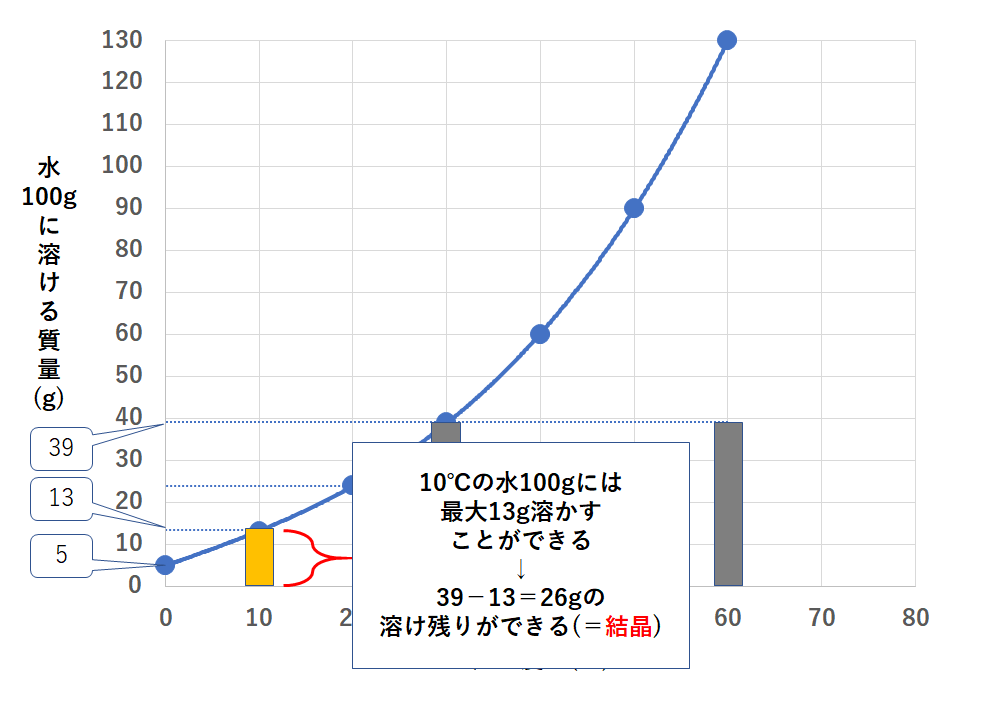
③10℃まで下げたとき
10℃では水100gに物質Xを13gまで溶かすことができます。
いま物質Xを39g溶かしていました。
これがすべて溶けることはありません。
水に溶けるのは13gです。
よって 39-13=26g 溶け残ることになります。
この溶け残りを顕微鏡などで見ると、平面で囲まれており規則正しい形をしています。
これを結晶と言います。
このように温度を下げていくと溶解度は小さくなります。
そしていつかは溶け残り=結晶があらわれます。
温度を下げることで結晶を取り出す方法を再結晶(法)といいます。
温度による溶解度の変化を利用している。
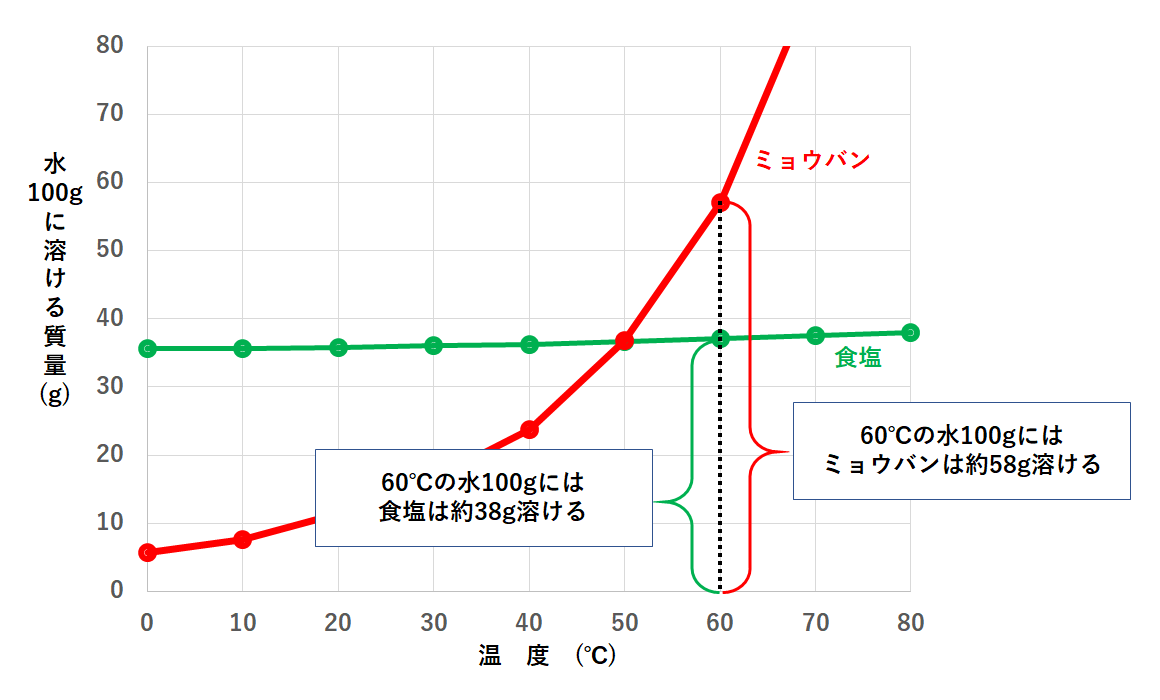
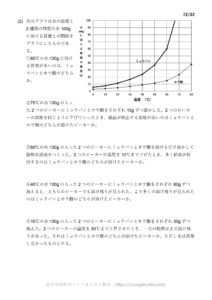
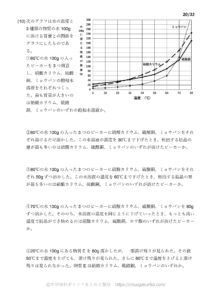
例.食塩とミョウバンの溶解度
次のグラフは食塩とミョウバンの溶解度曲線です。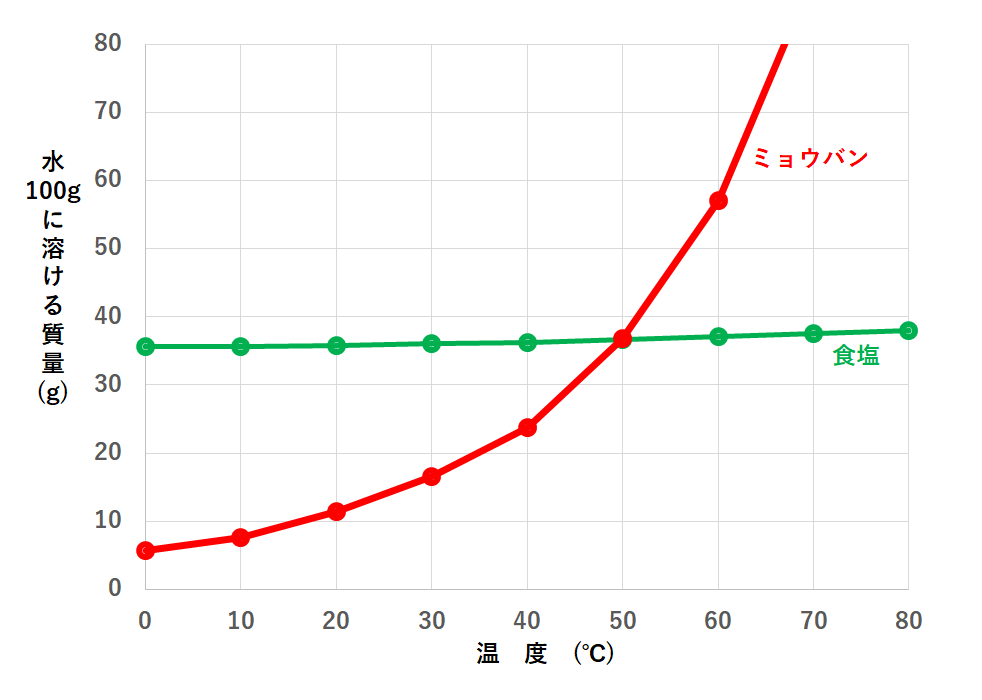
ここで60℃の水100gに食塩またはミョウバンを溶けるだけ溶かして2つの飽和水溶液をつくったとします。
10℃まで温度を下げたとき、食塩またはミョウバンのどちらの結晶の方が多く取り出せるでしょうか。
まずそれぞれの溶解度を調べましょう。
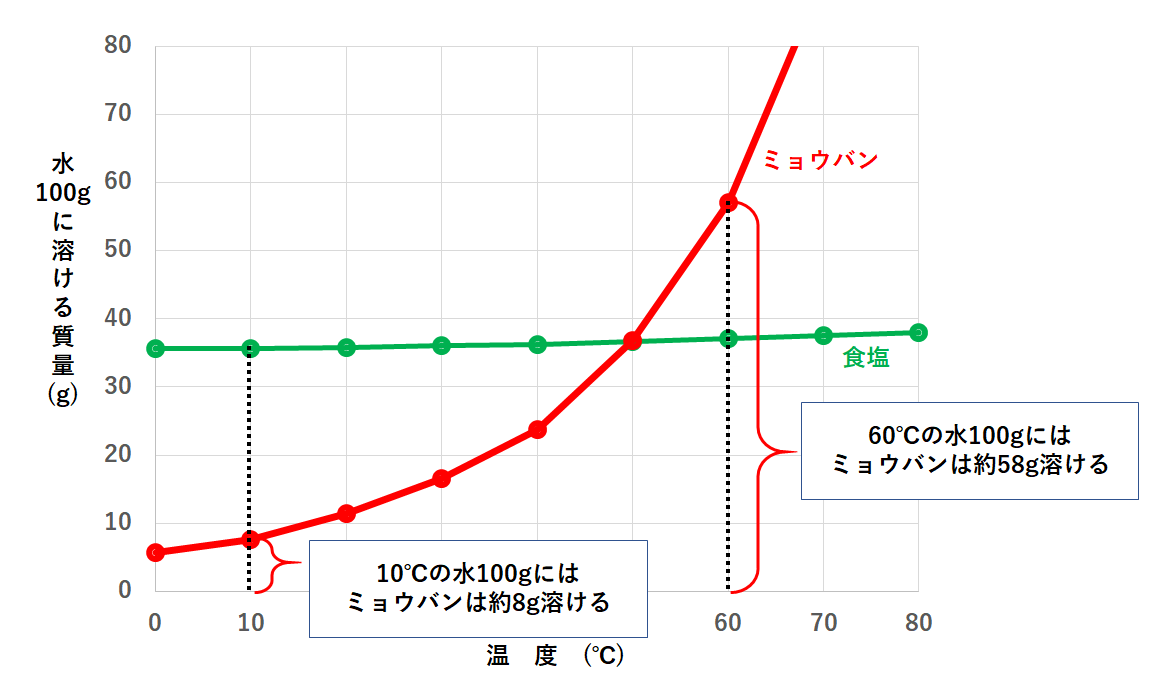
次に10℃でのミョウバンの溶解度を見てみましょう。
よって58-8=50gの結晶が取り出せることになります。
次に10℃での食塩の溶解度を見てみます。
よって38-36=2gの結晶が取り出せます。
つまりミョウバンの結晶が多く取り出せます。
一方で食塩は少ししか結晶が取り出せません。
食塩の溶解度は温度によってあまり変化しないため、食塩の結晶を取り出すのに再結晶はあまり適しません。
(ふつうは水分を蒸発させて結晶を取り出します。)
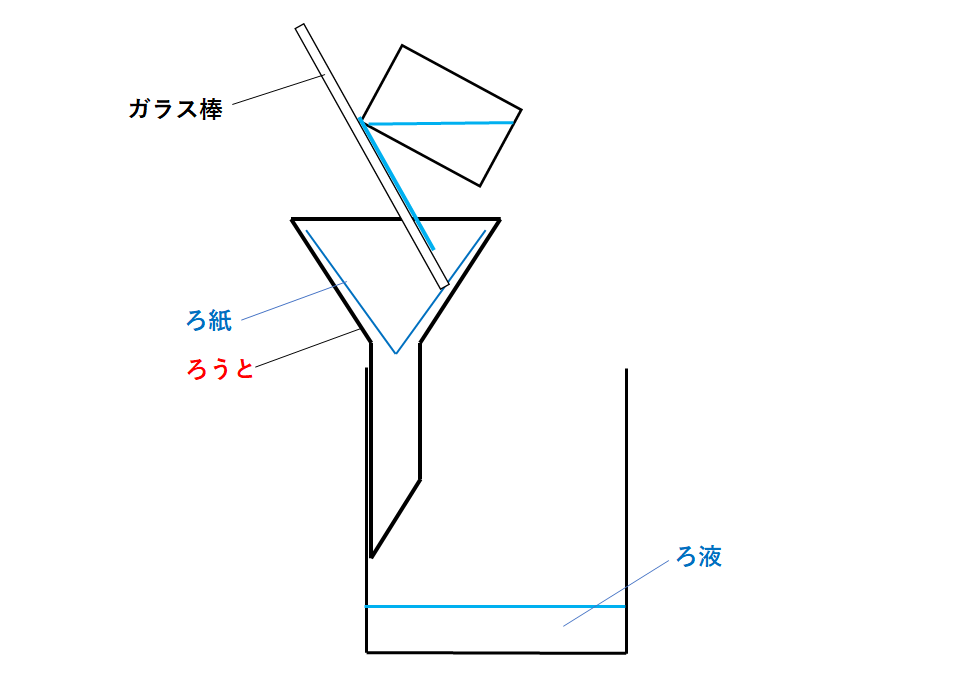
2.ろ過
液体の中に混じった不純物を取り出す操作。
液体に溶けていない物質はろ紙上に残る。
液体に溶けている物質はろ紙を通過してしまう。(ろ液に入る)
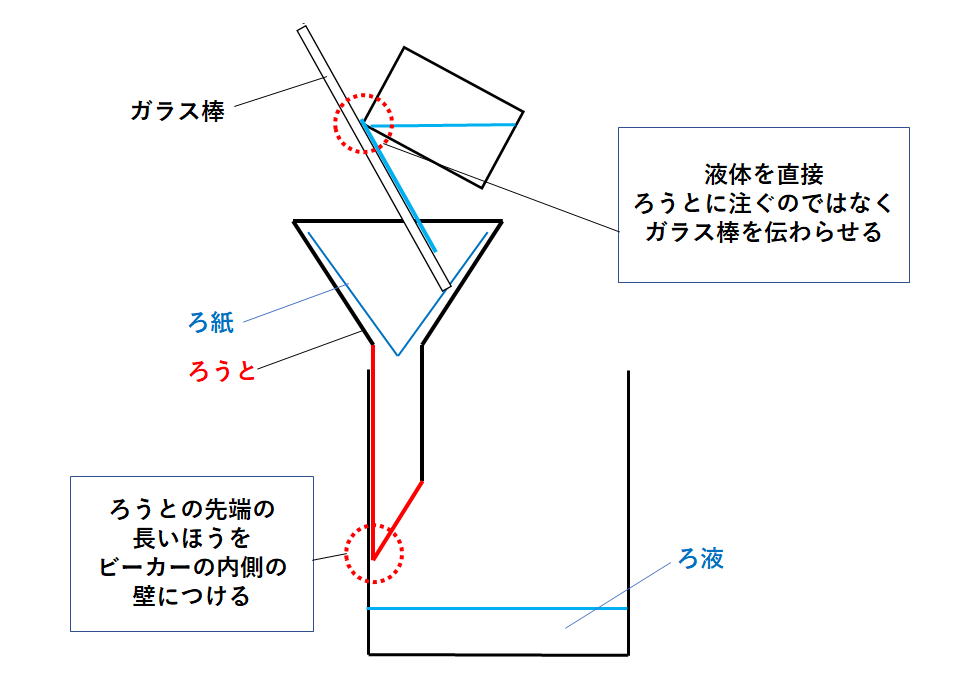
ろ過では次の2つの注意点を押さえておきましょう。
POINT!!
・溶解度は「水100g」を基準にしていることを覚えておこう。
・溶け残った物質が結晶である。
・再結晶は溶解度の差を利用しているので、差がなければ結晶はほとんど取り出せない。(特に食塩)
こちらもどうぞ
溶解度の計算問題をつくりました。
こちらにて販売中です。(PDFファイルのダウンロード販売です)
1ファイルで220円です。よければどうぞ。

コメント(承認された場合のみ表示されます)