このページでは「ダニエル電池のしくみ」「ダニエル電池の各極で起こる反応」「素焼き板(セロハン膜)の役割」について解説しています。
ダニエル電池を理解するためにはボルタ電池などの電池のしくみをこちらで理解しておきましょう。→【電池のしくみ】←
ダニエル電池の動画による解説はこちらから↓↓↓
チャンネル登録はこちらから↓↓↓
1.ボルタ電池の問題点
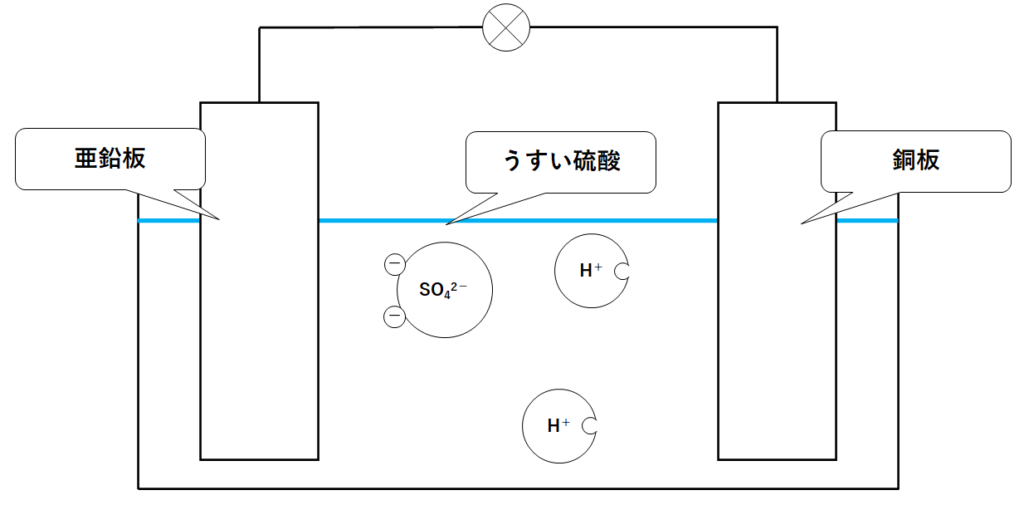
ボルタ電池は↓のように亜鉛板・銅板・硫酸を用いて作られる電池です。
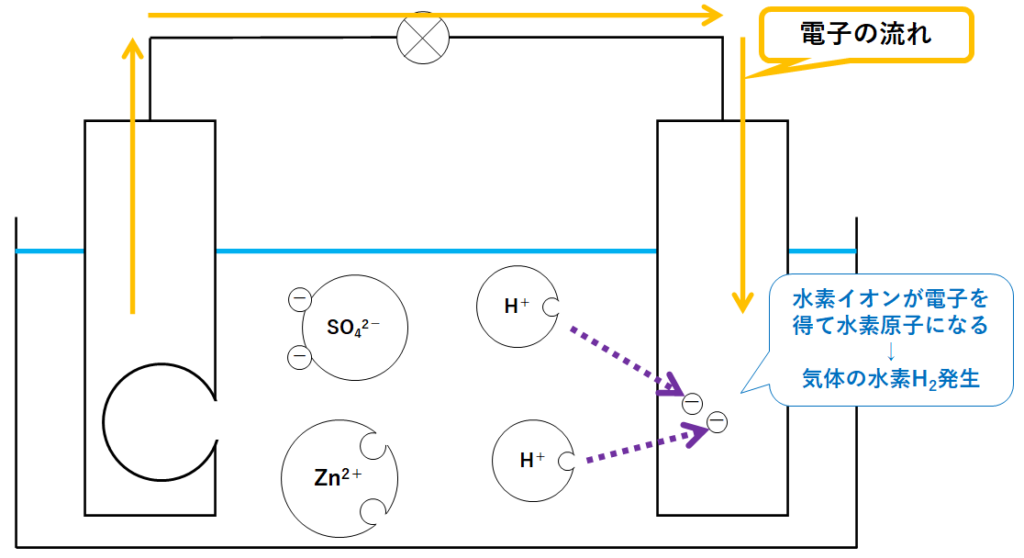
ボルタ電池では銅板から水素の気体が発生します。
(水素イオンが銅板から電子をもらう(↓の図))
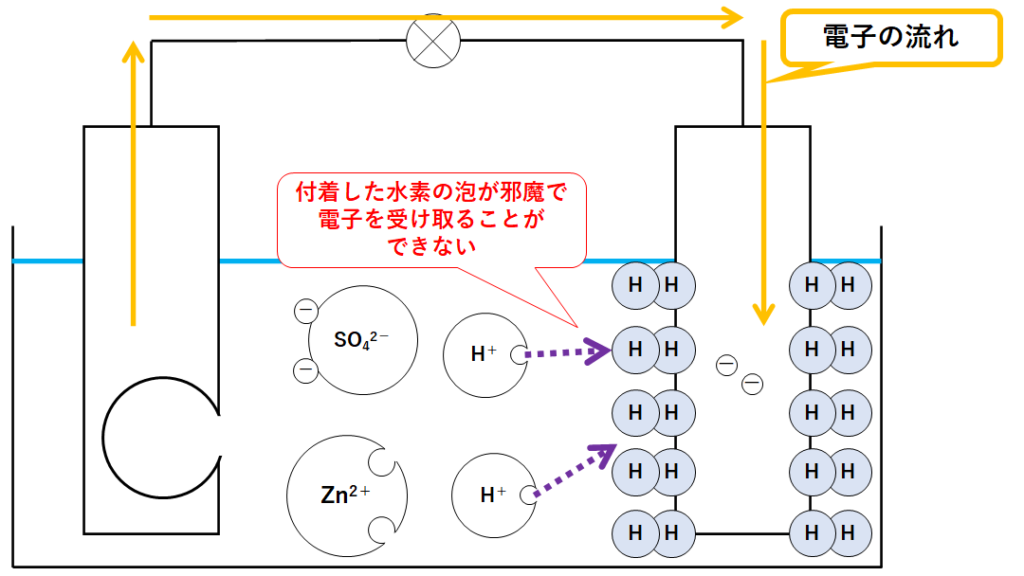
反応が進むにつれて銅板に水素の泡がたくさん付着していきます。(↓の図)
これがボルタ電池の問題点です。
水素の泡が付着することで、水素イオンが電子を受け取ることができなくなります。
その結果、電池の電圧(起電力)が低下し、使い物にならなくなります。
これを分極作用といいます。
■分極作用
極板に電気を通さない物質が付着することで、電気を通さなくなること。
POINT!!
ボルタ電池の問題点
銅板に水素の泡が付着することで、起電力が低下する。(分極作用)
2.ダニエル電池
イギリスの学者であるジョン・フレデリック・ダニエルさんはボルタ電池の問題点を解決すべく改良を行いました。
ダニエルさんの発明した「ダニエル電池」はこの分極作用が起こらないように改良が加えられた電池です。
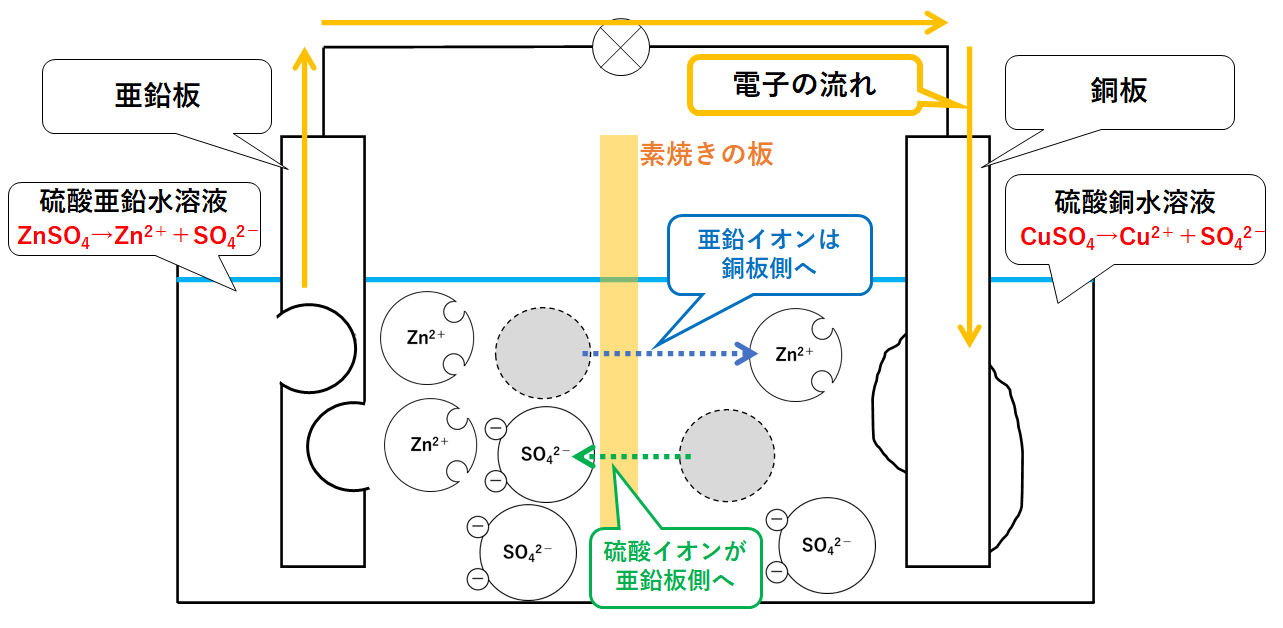
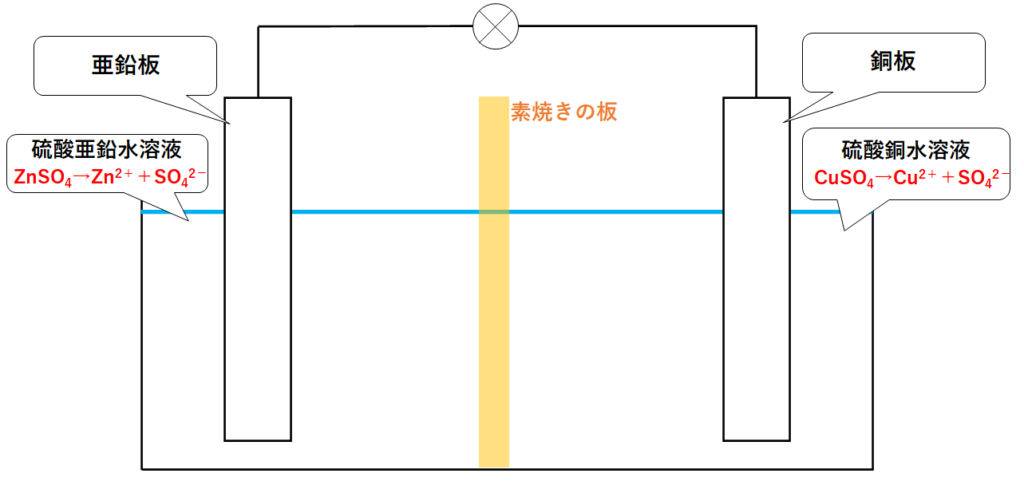
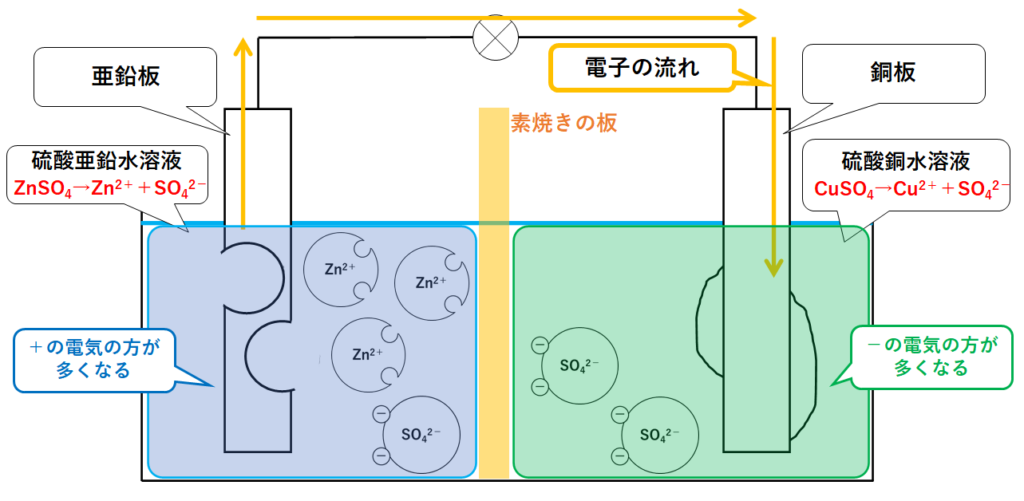
ダニエル電池の構造
ダニエル電池では、亜鉛板と銅板で気体が発生しない(分極作用が起こらない)ように改良がなされています。
用いる電極は亜鉛板と銅板です。
電解質水溶液としては、硫酸亜鉛水溶液と硫酸銅水溶液の2種類を、素焼きの板(セロハンの場合もあります)で仕切りながら使われています。(↓の図)
硫酸亜鉛と硫酸銅は次のように電離します。
ZnSO4 → Zn2+ + SO42-
CuSO4 → Cu2+ + SO42-
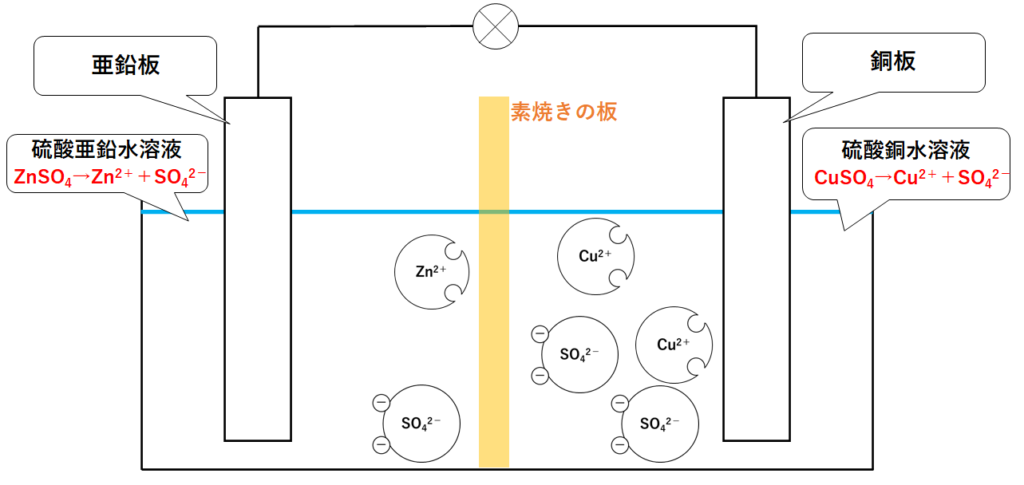
よって容器の左側には亜鉛イオンZn2+と硫酸イオンSO42-が存在します。
また容器の左側には銅イオンCu2+と硫酸イオンSO42-が存在します。(↓の図)
ダニエル電池のしくみ
①イオン化傾向
亜鉛と銅では、亜鉛の方がイオン化傾向が大きいです。
つまり
亜鉛・・・(陽)イオンになりたい
銅・・・・(陽)イオンになりたくない
というちがいが生じます。
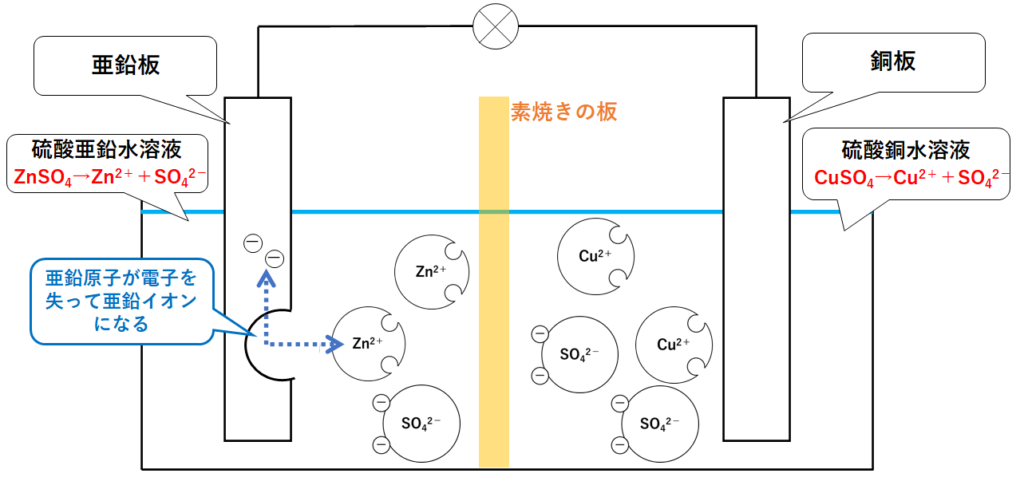
②亜鉛板での変化
イオン化傾向の大きな亜鉛がイオンとなります。
具体的には
亜鉛原子Znが、電子を失って亜鉛イオンZn2+となる
という変化が起こります。(↓の図)
式で書くと Zn → Zn2+ + 2e-
※e-は電子のこと
見た目では、亜鉛板はどんどん溶けだし、質量が減少します。
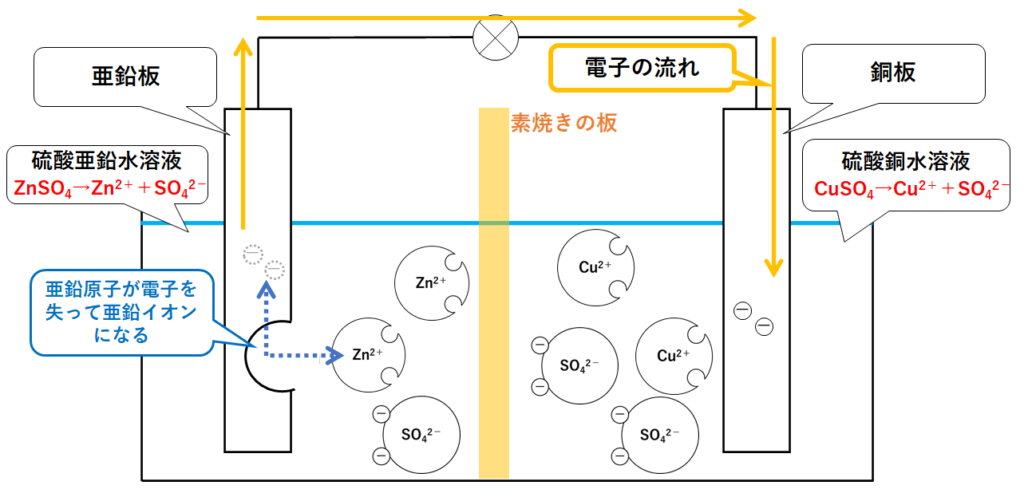
③銅板での変化
亜鉛原子が手放した電子は、導線を通って銅板にたどり着きます。(↓の図)
放っておくと銅板にはどんどん電子がたまります。
この電子を受け取るのが、液中の銅イオンCu2+です。
(ボルタ電池では水素イオンが受け取りました)
銅はイオン化傾向が小さい金属です。
つまりイオンの姿はいやだ、原子にもどりたいということです。
具体的には
銅イオンCu2+が、電子を得て銅原子Cuとなる
という変化が起こります。(↓の図)
式で書くと Cu2+ + 2e- → Cu
見た目では、銅が析出し、銅板の質量が増加します。
POINT!!
・亜鉛板では・・・
→ 亜鉛原子が、電子を失って亜鉛イオンとなる。
・銅板では・・・
→ 銅イオンが、電子を得て銅原子となる。
素焼きの板の役割
①左側(硫酸亜鉛水溶液)の濃度の変化
左側では、亜鉛イオンがどんどん生じます。
最初と比べて亜鉛イオンの濃度が高くなります。
左側は、全体として+にかたよることになります。
(+の電気の方が多くなる)
②右側(硫酸銅水溶液)の濃度の変化
右側では、銅イオンがどんどんなくなります。(銅原子へと変化する)
最初と比べて銅イオンの濃度が低くなります。
右側は、全体として-にかたよることになります。
(-の電気の方が多くなる)
③素焼きの板による調整
電子は-の電気を持つので、+と引き合い、-としりぞけ合います。
そのため電子が左側から右側に移動がしづらくなり、徐々に電池の電圧(起電力)が低下します。
素焼きの板(またはセロハン膜)はこれを防ぐための役割を持ちます。
素焼きの板やセロハン膜にはイオンが通過できるほどの小さな穴が開いています。
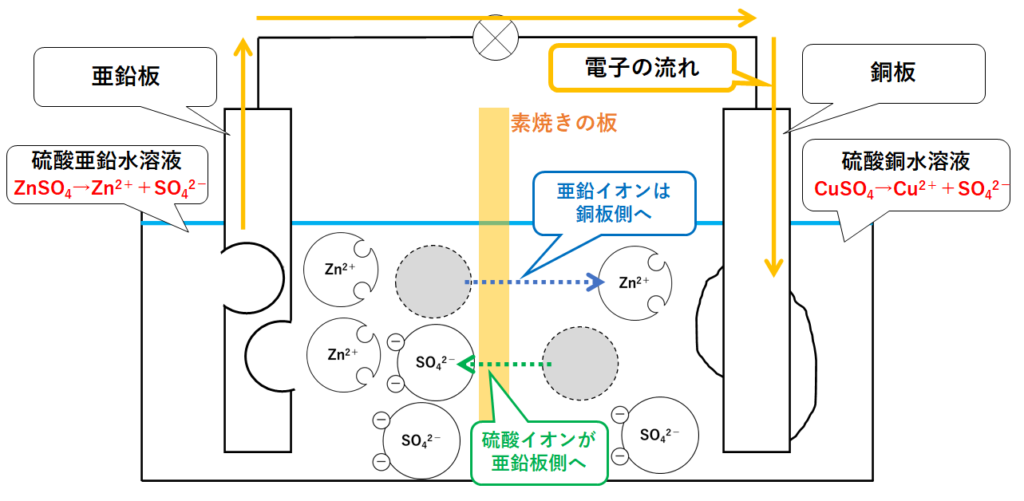
左側は+にかたよっているので、右側から硫酸イオンSO42-が移動してきます。
右側は-にかたよっているため、左側から亜鉛イオンZn2+が移動してきます。(↓の図)
こうなることで左右ともに電気的に中性の状態に保たれます。
つまり起電力の低下を防ぐことができます。
POINT!!
素焼きの板は左右の液を電気的に中性に保っている。
反応が進むと・・・
亜鉛イオンが銅板側へ(硫酸銅水溶液の方へ)。
硫酸イオンが亜鉛板側へ(硫酸亜鉛水溶液の方へ)。
ダニエル電池の注意点
①硫酸亜鉛水溶液の濃度は低くしておく。
反応が進むと亜鉛イオンが液中に溶けだします。
できるだけ亜鉛イオンの居場所をつくるために、硫酸亜鉛水溶液の濃度を低くしておきます。
(亜鉛イオンを溶けだしやすくする)
そうすると電池が長持ちします。
②硫酸銅水溶液の濃度は高くしておく。
反応が進むと液中の銅イオンが減少していきます。(銅原子に変わる)
はじめの銅イオンが少ないと、すぐ反応が終わってしまいます。
そのため銅イオンがたくさんある状態にするために、硫酸銅水溶液の濃度を高くしておきます。
(銅原子を析出しやすくする)
そうすると電池が長持ちします。


コメント(承認された場合のみ表示されます)
ポイントのところで、
「銅イオンが、電子を得て銅イオンとなる。」
となっています。
正しくは
「銅イオンが、電子を得て銅原子(銅)となる。」
ではないでしょうか。
同業者様
ご指摘ありがとうございます。
おっしゃる通りです。
修正いたします。
教科書よりも5倍くらい分かりやすかったです。
ありがとうごさいます。
カレラ様
コメントありがとうございます。
お役に立てたようで何よりです。
これからもいつでもご覧ください。
うっわ笑わかりやす
ななし様
コメントありがとうございます。
理解いただけてよかったです。
また是非ご活用ください。
銅板側にいった亜鉛イオンは銅板で電子を受け取って亜鉛にならないんですか?
カメラ様
コメントありがとうございます。
亜鉛イオンは銅イオンに比べるとイオン化傾向が大きいです。
イオン化傾向が大きい金属は「イオンになる」または「イオンのまま」です。
そのため電子を受け取ることはしません。
ボルタ電池とダニエル電池の違いはなんですか。
nakaharu様
コメントありがとうございます。
ボルタ電池は水溶液に「うすい硫酸」を使っています。
ダニエル電池は水溶液に「硫酸亜鉛水溶液と硫酸銅水溶液」を使っています。
構造としてはこの点が違います。
ボルタ電池のより詳しい説明はhttps://chuugakurika.com/2018/01/12/post-1359/をご覧ください。
授業中に見たけど授業よりわかりやすかった!
第一の生徒 サボリエル様
コメントありがとうございます。
お役に立てたなら幸いです。
また是非ご利用下さい。
わかりやすかったです!!!ありがとうございます・ω・
紗夏様
コメントありがとうございます。
お役に立てたなら幸いです。
またいつでもご覧くださいね。
これで期末テスト勉強します!!
亜鉛が溶ける様
コメントありがとうございます。
お役に立てれば幸いです。
テスト頑張ってくださいね。
何回教科書見ても分からないことがわかりました!
金銀銅の鉄人に 会えたらマグロと納豆を
軽く借りると ボロボロだ
イオン化傾向の語呂合わせ 弱→強
を作ってみました
他に良いものありませんか‥
深井様
コメントありがとうございます。
語呂合わせまでありがとうございます!
Na Mg Al Zn Fe Cu Ag
なんと 曲がるぜ 鉄 道 と銀
という語呂合わせをつかっています。
よければどうぞ。
ありがとうございます!
助かります。ありがとうございます
名無し様
コメントありがとうございます。
お役に立てたならうれしいです。
またいつでもご覧ください。
コメント失礼いたします。
定期テストの問題で「ダニエル電池で銅板を覆うセロハンチューブが無い場合、電流は流れるか」という問題で、
模範解答は「流れない」とありました。
自分の理解では、「起電力が低下するが、流れるか流れないかで言ったら、流れる」なのですが、実際はどうなりますでしょうか。
ご回答いただければ幸いです。
ごん様
コメントありがとうございます。
硫酸銅水溶液と硫酸亜鉛水溶液が均一に混ざっているとした場合、
銅イオンが電子を受け取り銅原子になる反応が亜鉛板付近で起こってしまうことになります。
その場合、電池として機能しないので、「流れない」となると思われます。
science teacher様
早速のご回答ありがとうございます!
納得いたしました! わかりやすいご説明をありがとうございました!!
分かりやすかったです!
ありがとうございます。
一つ気になったのですが、ダニエル電池の構造のところは、容器の左側には硫酸イオンと亜鉛イオン、「右」側には硫酸イオンと銅イオンではないでしょうか。
間違っていたらすみません。
侍魂様
コメントありがとうございます。
ご指摘の通りですね…。
訂正しておきます。ご指摘感謝します。
質問があります。
硫酸亜鉛水溶液の入った試験管に亜鉛の小片を入れたときは変化しないのに、ダニエル電池では溶けていくのはなぜですか?
理系苦手娘様
コメントありがとうございます。
ダニエル電池で反応が起こるのは、亜鉛板と硫酸亜鉛水溶液との関係が原因なのではなく、亜鉛板と銅板が導線でつながっていることです。
イオン化傾向の異なる2つの金属板が導線でつながる(電子が移動しやすくなる)ことが反応の原因です。
なぜ硫酸亜鉛水溶液の濃度を低くするとダニエル電池が長持ちするのはなぜなんでしょうか。
玲香様
コメントありがとうございます。
亜鉛板の一部が亜鉛イオンとなり、硫酸亜鉛水溶液の中に溶けだします。
その際に、硫酸亜鉛水溶液の濃度が低いと、亜鉛イオンが溶け出すスペースが多く残されていることになり、結果長持ちすることになります。
質問です。
硫酸亜鉛水溶液の濃度を低くし、硫酸銅水溶液の濃度を高くしておくことで電池が長持ちすると書いてありますが、水溶液の濃度以外に長持ちさせる工夫はできますか?(亜鉛、銅板の厚みを変えるなど)
よろしくお願いします🙌
生徒様
コメントありがとうございます。
硫酸亜鉛水溶液の濃度を低くし、硫酸銅水溶液の濃度を高くしておくことは、電池の長持ちに必ず必要かと思います。
そのうえで、亜鉛板の質量を大きくしておくと長持ちしやすいかつ大きな電流が流れやすいと思われます。
とてもわかり易かったです
有難うございました
MK様
コメントありがとうございます。
お役に立ててよかったです。
またいつでもご利用くださいね。
すごく分かりやすかったです!ありがとうございました!
質問です。
銅イオンはセロハンを通らないのでしょうか?
他のイオンが通るのだったら、銅イオンも通るのではないかと考えてしまいます。でも、亜鉛板に移動してしまったら、電子が導線に流れなくなってしまいますよね、、あれ、どんどんわからなくなってきました。
回答お願いします。
つき様
コメントありがとうございます。
硫酸亜鉛水溶液側は亜鉛イオンが生成することで、+の電気が強くなります。
そのため銅イオンはしりぞけられて硫酸亜鉛水溶液側に入ることはできません。
実際の実験ではごくわずかに移動はするようですが、無視できるレベルのようです。
なぜ陰極側の亜鉛版がいきなり亜鉛イオンと電子にわかれるのですか?
プリッッッッツ様
コメントありがとうございます。
亜鉛板と銅板を導線でつなぐとイオン化傾向のちがいがきっかけで亜鉛イオンが電子になります。
とても分かりやすかったです‼︎
質問なのですが、素焼きがある事で少しずつイオンを移動させているのは分かったのですが、一気に水溶液が混ざると何がいけないのでしょうか。教えていただけると幸いです!
ANPANMAN様
コメントありがとうございます。
硫酸銅水溶液と硫酸亜鉛水溶液が混ざってしまうと、
銅イオンが電子を受け取り銅原子になる反応が亜鉛板付近で起こってしまうことになります。
その場合、電池として機能しなくなります。
どうでも良い質問ですが、、、
1.ダニエル電池の銅板をマグネシウム板に、
硫酸銅水溶液を硫酸マグネシウム水溶液に変えても電流は流れますか?
2.ダニエル電池は銅板に浸かっているのは硫酸銅水溶液ですが
この硫酸銅水溶液を硫酸鉄水溶液に変えても電流は流れますか?
また、電気的な偏りについての問題は発生しますか?
受験と関係は無いとは思いますが回答していただけると幸いです。。。
あたおかの人←受験生様
コメントありがとうございます。
1.→電流は流れると思います。
2.→電流は流れると思います。銅板に鉄が発生すると思われます。
なぜ亜鉛が含まれている水溶液に亜鉛板を入れても亜鉛板の亜鉛が電離してイオンになるのでしょうか?
受験がんばる様
コメントありがとうございます。
亜鉛と銅板が導線でつながると、イオン化傾向のちがいが原因で、どちらかがイオンになろうとします。
亜鉛の方がイオン化傾向が大きいので、亜鉛イオンが生じます。
問題集で
Zn → Zn2+ + 2e-
Cu2+ + 2e- → Cu
が解答になっている問題で
ZnSO4 → Zn2+ + SO42-
CuSO4 → Cu2+ + SO42-
と答えたら不正解になるんですか?
カートコバーン様
コメントありがとうございます。
Zn → Zn2+ + 2e-
Cu2+ + 2e- → Cu
↑の2つの反応は、亜鉛板や銅板で起こる反応です。
ZnSO4 → Zn2+ + SO42-
CuSO4 → Cu2+ + SO42-
↑の2つの反応は、硫酸亜鉛水溶液と硫酸銅水溶液の電離を表す式になります。
異なる変化を答えているので×になります。
わかりやすい説明で助かりました。定期テストで無双できそうです。
男子中学生様
コメントありがとうございます。
お役に立てたなら幸いです。
またぜひご利用ください。
一つ質問したいのですが、「硫酸亜鉛水溶液の濃度を低くしておきます」と「硫酸銅水溶液の濃度を高くしておきます」とありますが、両方とも硫酸の濃度を下げるのですか?それとも亜鉛や銅の濃度を下げるのですかね?
それとも溶液自体の濃度を下げるのですか?
今、ダニエル電池の考察を学校から出されまして、少々行き詰まっているので、教えていただけたら幸いです
訂正
「両方とも硫酸の濃度を下げるのですか?それとも亜鉛や銅の濃度を下げるのですかね?
それとも溶液自体の濃度を下げるのですか?」
と書きましたが、訂正で
硫酸のみを変化させるのか、溶質である亜鉛と銅を変化させるのか、それとも水溶液自体を変化させるのですか?
訂正
「両方とも硫酸の濃度を下げるのですか?それとも亜鉛や銅の濃度を下げるのですかね?
それとも溶液自体の濃度を下げるのですか?」
と書きましたが、訂正で
硫酸のみを変化させるのか、溶質である亜鉛と銅を変化させるのか、それとも水溶液自体を変化させるのですか?
周防2様
返信が遅くなり大変申し訳ございません。
「硫酸亜鉛水溶液」は「水に硫酸亜鉛という物質を溶かした水溶液」です。
これの濃度を低くするとは、水に溶かす硫酸亜鉛の量を少なくする、ということです。
すると、硫酸亜鉛によって生じる硫酸イオンと亜鉛イオンの量も自動的に少なくなります。
「硫酸銅水溶液」は「水に硫酸銅という物質を溶かした水溶液」です。
これの濃度を高くするとは、水に溶かす硫酸銅の量を多くする、ということです。
すなわち、硫酸銅によって生じる硫酸イオンと銅イオンの量も自動的に多くなります。
何故ボルタ電池では電離してH+
が出ているのにダニエル電池では
出ていないのでしょうか
中学せい様
返信が遅くなり大変申し訳ございません。
ボルタ電池では液体に硫酸や塩酸を使用しています。
これらの液体からは水素イオンが生じています。
一方でダニエル電池では硫酸亜鉛水溶液や硫酸銅水溶液を使用しています。
これらはもともと水素イオンが含まれていません。
そのためダニエル電池では水素イオンが生じていません。
期末テストの勉強で拝見しましたが、とても分かりやすいです!
ありがとうございます。
素焼きの板やセロハン膜は、イオンを通す小さい穴があるとありましたが、イオンの粒は、水の分子よりも小さいのでしょうか。
水がH₂Oで、硫酸イオンがSO₄²⁻ということを考えると、硫酸イオンの方が大きい気がするのですが…
メガネ様
コメントありがとうございます。
イオンの半径(大きさ)は、原子やイオンの数だけでなく、中に含まれる電子の数や陽子の数などにも左右されます。
そのため、原子やイオンの数が少ないものが小さいとは言い切れません。
実際、硫酸イオンは水分子よりも小さいです。
すみません!一つ質問があります。
先日学校のダニエル電池の授業で、わざとセロハンや素焼きを外して水溶液を混ぜるという実験をしました。
私は電流が流れなくなると予想していたのですが、実際はセロハンなどがある時よりも大きい電流が流れました。これはなぜなのでしょうか?(先生はイオンの行き来によって数が増えるからと言っていましたがあまり合点が行きません。)理由を教えていただきたいです。
しゃけの焦げ様
コメントありがとうございます。
液体の混ざり具合や容器の大きさなどにもよるかとは思いますが、はじめは亜鉛板付近で硫酸イオンの濃度が高いなどのかたよりがあれば大きな電流が流れると思います。
ただ、亜鉛板に銅が析出し、素焼きやセロハンを使った場合に比べて長持ちはしないと考えられます。
めっちゃ分かりやすい
T様
コメントありがとうございます。
ご理解のお役に立てていれば幸いです。
またぜひご活用ください。
素焼きの板を、イオンを通さない板に変えるとどのような反応になるのでしょうか
ちかげ様
コメントありがとうございます。
最初だけ電流が流れてすぐに流れなくなることが予想されます。
硫酸銅亜鉛水溶液側が+に、硫酸銅水溶液側が-にかたより、電子が動かなくなります。