このページではアンモニアの性質を利用したアンモニアの噴水実験についてその原理や理由を解説します。
主な気体の性質については→【気体の性質】←を参考に。
動画による解説はこちら↓↓↓
チャンネル登録はこちら↓↓↓
1.アンモニアの性質
アンモニアには以下のような性質があります。
①水によく溶ける。
②空気より軽い。
③水に溶けるとアルカリ性を示す。
④刺激臭がある。
⑤有毒。
などなど・・・
これらの性質のうち①~③を利用して噴水の実験を行います。
2.噴水実験の原理・理屈
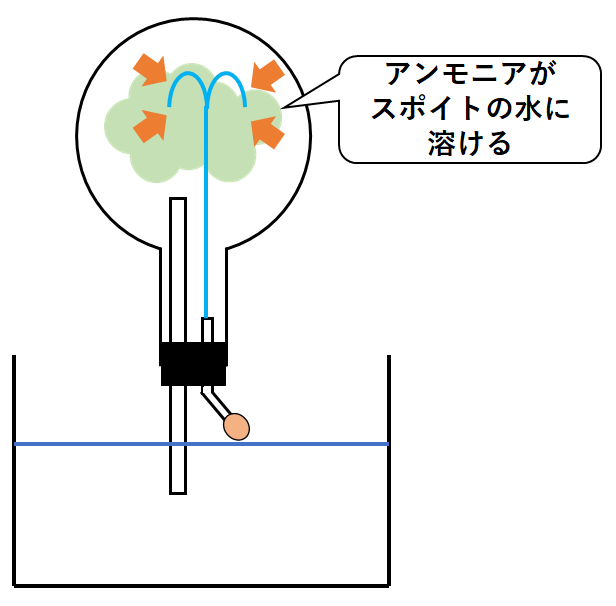
丸底フラスコにアンモニアを満たして↓のようにセットします。
※アンモニアは本当は無色です。図はイメージです。
スポイトには水を入れておきます。
ここで、スポイトでフラスコ内に水を入れます。
アンモニアは非常に水に溶けやすいので、このスポイトで加えた水にも溶けてしまいます。(↓の図)
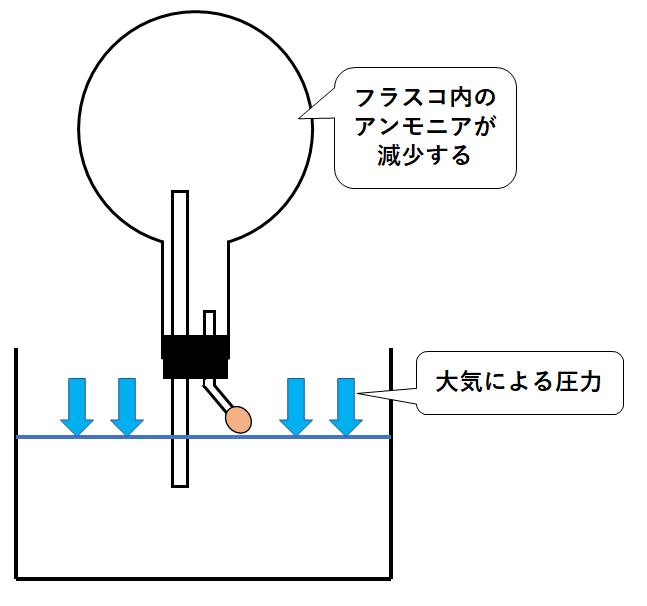
フラスコ内のアンモニアは大きく減少。
つまりフラスコ内の気圧は減少します。
一方で、水そうの水には周囲の空気(=大気といいます)による圧力がはたらいています。(↓の図)
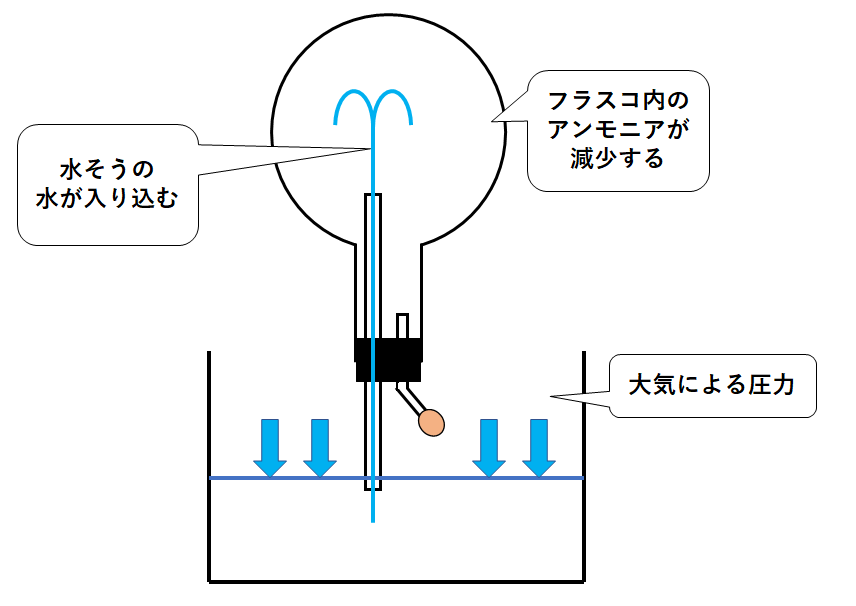
フラスコ内部の気圧が下がり、大気による圧力の方が高くなると、水そうの水面が押し下げられます。
水そうの水はガラス管に入り込み、まるで噴水のようになります。(↓の図)
ここで水そうの水にフェノールフタレイン溶液を加えておきます。
フェノールフタレイン溶液はアルカリ性に反応して赤色へと変化する薬品です。
アンモニアは水に溶けるとアルカリ性です。
よって赤色の噴水ができることになります。


コメント(承認された場合のみ表示されます)