このページでは「イオン化傾向とは何か」「イオン化傾向のちがう金属どうしで起こる反応(酸と金属・硫酸銅水溶液と金属)」について解説しています。
動画による解説は↓↓↓
チャンネル登録はこちらから↓↓↓
1.イオン化傾向とは
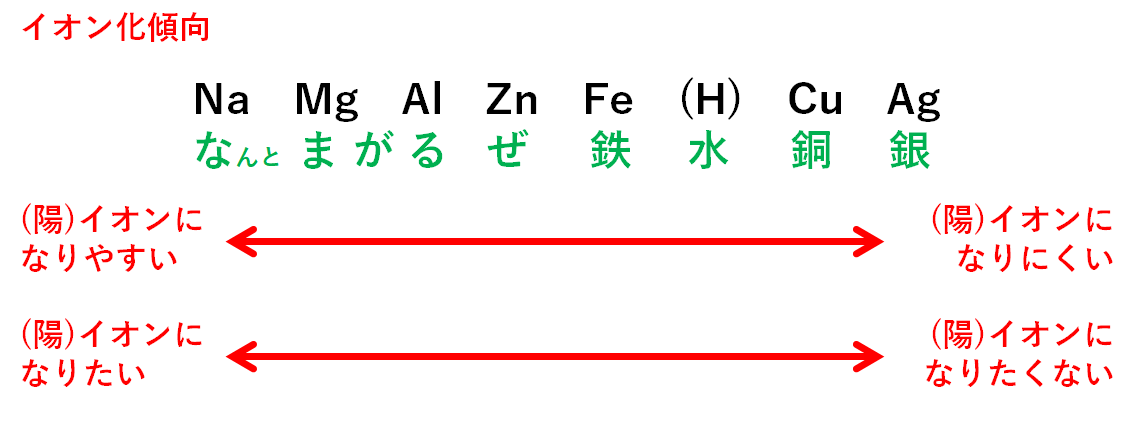
金属原子や水素原子のイオンへのなりやすいさのこと。
以下の原子はどれも陽イオンになる可能性があるものばかりです。(陰イオンにはなりません)
どれくらい陽イオンになりやすいのか、そのなりやすさを表すのがイオン化傾向です。
イオン化傾向の大きい左のものは
イオンになりやすい・イオンでいたい
ということです。
イオン化傾向の小さい右のものは
イオンになりにくい・イオンではいたくない
ということ。
言い換えます。
イオン化傾向の大きいものは・・・
・最初の状態が原子ならイオンになろうとする
・最初の状態がイオンならイオンのまま
です。
イオン化傾向の小さいものは・・・
・最初の状態が原子なら原子のまま
・最初の状態がイオンなら原子になろうとする
です。
2.イオン化傾向の違いで起こる化学変化
イオン化傾向の差によって化学変化が引き起こされることがあります。
中学では主に3つを学習します。
①酸と金属の反応
②硫酸銅と金属イオンの反応
③電池
このページでは①と②について解説します。
※電池については →【電池の仕組み】← / →【ダニエル電池の仕組み】←
①酸と金属の反応
酸とは電離して水素イオン H+を生じる物質のこと。
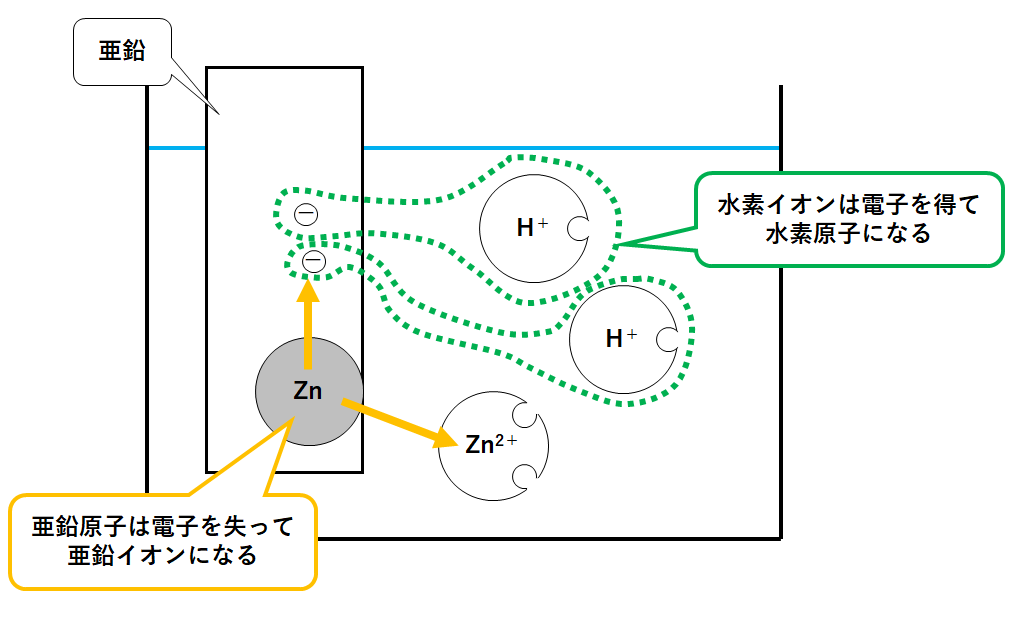
酸に亜鉛 Zn の金属板を入れてみます。
水素イオン H+と亜鉛原子 Zn が存在しています。
ここでHとZnのイオン化傾向を比べてみましょう。
イオン化傾向の大きいのは Zn、小さいのは Hです。
つまり・・・
・亜鉛原子 Zn はイオンになろうとする。
・水素イオン H+は原子になろうとする。
ということ。
そして Zn は Zn2+になるために電子を2個はなします。
水素イオン H+はその電子をもらって水素原子 H になろうとします。
この水素原子が2つずつ結びつき、水素分子H2(水素の気体)として発生します。(↓の図)
この変化をイオン式や化学式で表すと
・亜鉛原子Znの変化 Zn → Zn2+ + 2e-
・水素イオンH+の変化 2H+ + 2e- → H2
よって
「酸」+「水素Hよりもイオン化傾向の大きい金属」
の組み合わせでは水素が発生します。(↓の図)
これは水素の代表的な発生方法です。
反対に「水素Hよりもイオン化傾向の小さいCuやAg」を酸に加えても、反応は起こりません。
CuやAgはイオン化傾向が小さい=原子のまま(イオンになろうとしない)ためです。
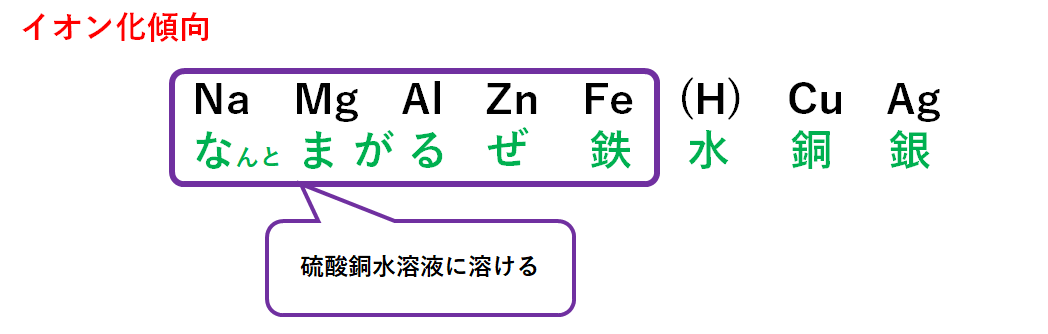
②硫酸銅水溶液と金属の反応
硫酸銅は化学式CuSO4で示される物質です。
液中では次のように電離します。
CuSO4 → Cu2+ + SO42-
この硫酸銅のとけた水溶液に金属を加えてみます。
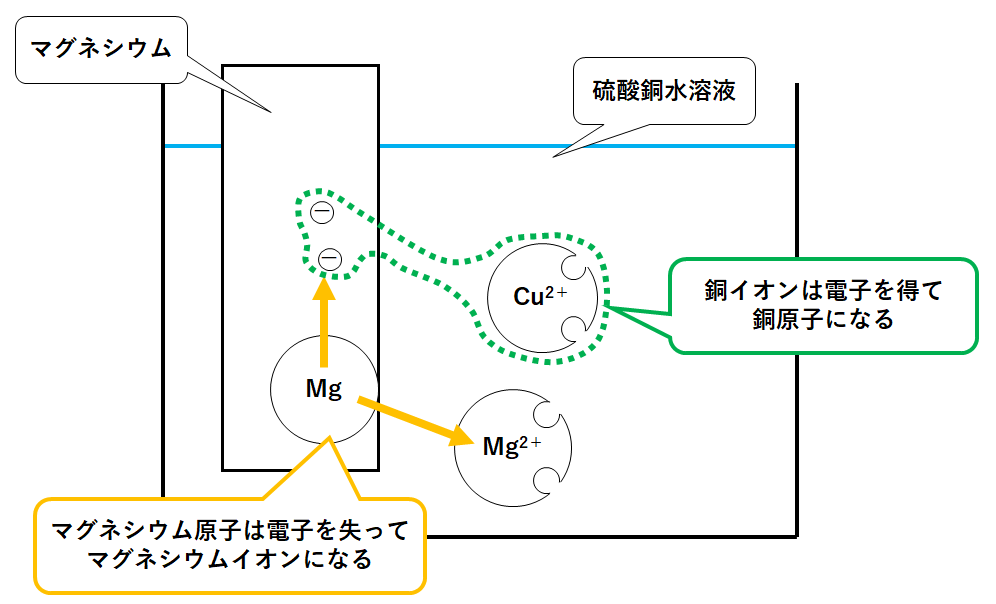
ここではマグネシウムを加えてみます。
マグネシウム原子 Mg と銅イオン Cu2+が存在しています。
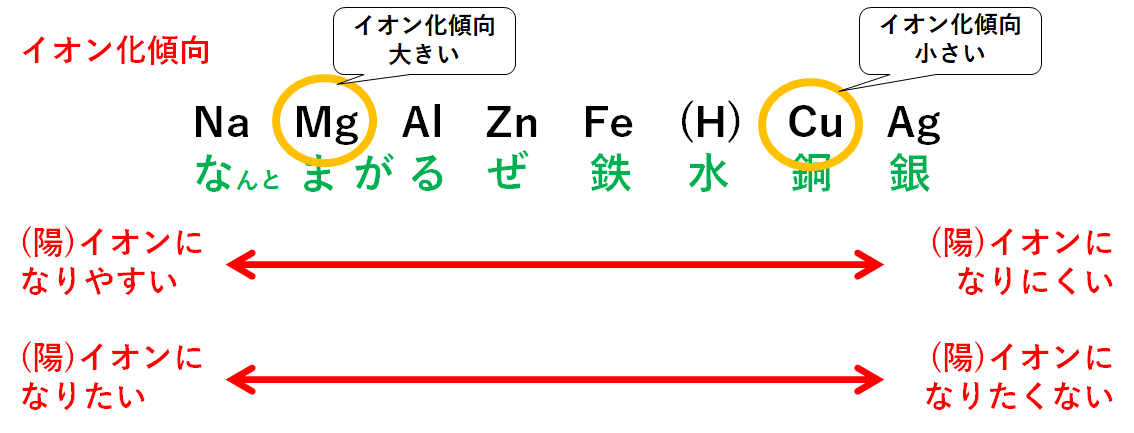
ここでイオン化傾向の大きさを比べます。
イオン化傾向が大きいのはMg、小さいのはCuです。
したがって
・マグネシウム原子Mgはイオンになろうとする。
・銅イオンCu2+は原子になろうとする。
ということです。
このためMgはMg2+になるために電子を2個はなします。
銅イオンCu2+はその電子をもらって銅原子Cuになろうとします。(↓の図)
この変化をイオン式や化学式で表すと
・マグネシウム原子Mgの変化 Mg → Mg2+ + 2e-
・銅イオンCu2+の変化 Cu2+ + 2e- → Cu
よって銅の固体が析出することになります。
このように
「硫酸銅水溶液」+「銅よりもイオン化傾向の大きい金属」
の組み合わせでは銅の固体が析出するという変化が見られます。(↓の図)
「銅よりもイオン化傾向の小さい金属」では反応は起こりません。
※銅のほうがイオン化傾向が大きい=銅イオンはイオンのまま。
ほかにも・・・
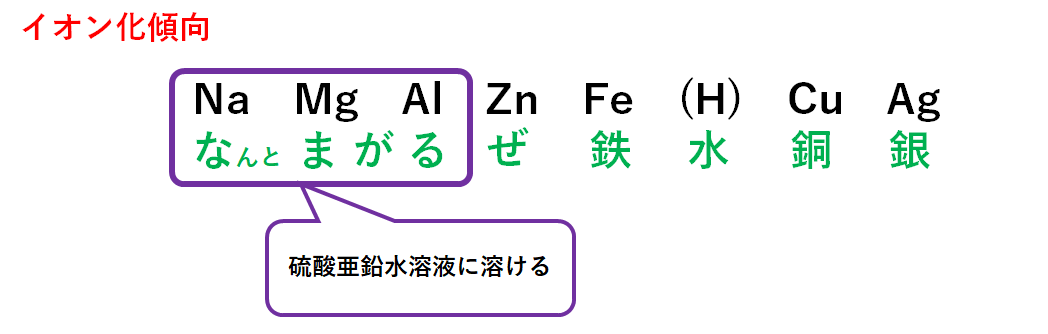
硫酸亜鉛水溶液に金属を加えた時を考えてみましょう。
硫酸亜鉛は次のように電離します。
ZnSO4 → Zn2+ + SO42-
この硫酸亜鉛水溶液に金属を入れたときに反応が起こるのは
「亜鉛よりもイオン化傾向の大きな金属」を入れたとき
です。
亜鉛よりもイオン化傾向の大きな金属を入れると
・その金属はイオン化傾向が大きいのでイオンとなり溶け出す。
・亜鉛イオンZn2+はイオン化傾向が小さいので原子になろうとする。
という反応が起こります。
以上のようにイオン化傾向の違う2種類が存在すると化学変化が起こることがあります。





コメント(承認された場合のみ表示されます)
分かりやすかったです
佐々木陽太様
コメントありがとうございます。
お役に立てたようでよかったです。
またいつでもご利用ください。